Современные представления о эфирных маслах: химия, биологическая активность и перспективы для сельского хозяйства Австралии. Обзорная статья, часть 2.
Авторы: Nicholas Sadgrove и Graham Jones
Agriculture 2015, 5(1), 48-102; https://doi.org/10.3390/agriculture5010048
1.4. Биосинтез и субъективная классификация эфирных масел
Эфирные масла классифицируются как вторичные метаболиты, полученные в результате различных процессов биосинтеза, начиная с фосфоенолпирувата, продукта гликолиза глюкозы, образующейся в процессе фотосинтеза. Вторичные метаболиты можно определить как компоненты, которые присутствуют у одних видов, но не присутствуют у других, что резко контрастирует с четырьмя первичными метаболитами, которые составляют основные строительные блоки жизни и, следовательно, присутствуют во всех формах жизни, состоящих из белков, углеводов, нуклеиновые кислоты и липиды. Из вторичных метаболитов наиболее значимыми в отношении эфирных масел являются терпеноиды и шикиматы, хотя поликетиды также встречаются в эфирных маслах и также редко встречаются в алкалоидах [17].
Фосфоенолпируват является предшественником как шикимовой кислоты, так и ацетилкофермента-А. Таким образом, фосфоенолпируват является важным перекрестком в синтезе вторичных метаболитов и некоторых первичных метаболитов, таких как липиды. На этом перекрестке эти метаболиты на пути ацетилкофермента-A включают липиды, поликетиды и терпены, в то время как метаболиты на пути шикимовой кислоты включают кумарины, флавоноиды (окрашенные компоененты) и лигнин. Особый интерес представляет лигнин - сложный мономер ароматических спиртов, называемых монолигнолами, неотъемлемая часть вторичной клеточной стенки растений. Липиды также включают свободные жирные кислоты, которые присутствуют в жирных маслах, а иногда и в эфирных маслах. Кроме того, некоторые эфирные масла являются продуктами распада липидов [17].
Там, где путь также расщепляется у ацетилкофермента-A, с одной стороны образуется мевалоновая кислота, состоящая из трех молекул ацетилкофермента-A. Это служит предшественником изопренов, которые являются строительным блоком терпенов. С другой стороны, происходит карбоксилирование ацетилкофермента-A с образованием малонил-кофермента-A. Он соединяется с уксусной кислотой, а затем декарбоксилатами дает β-кетоэфир. Если этот процесс повторяется, молекула образуется с карбонильной группой на каждом чередующемся атоме углерода, отсюда и название поликетид. В качестве альтернативы кетоновая функция может быть восстановлена до спирта, который затем удаляется с соответствующим гидрированием углерода и, следовательно, дает более высокий гомолог, давая начало жирной кислоте (липиду). Поскольку этот липидный путь соответствует синтезу поликетидов, существует объяснение того, почему жирные кислоты в большинстве своем имеют четную нумерацию [17].
Биосинтетическое происхождение шикиматов (или фенилпропаноидов) происходит от метаболического пути шикимовой кислоты. Сам биосинтез шикимовой кислоты начинается с ранее упомянутого фосфоенолпирувата и фосфата эритрозы-4, который является предшественником углеводов. Это означает, что биосинтез шикиматов отличается от углеводного пути [17].
Как упоминалось ранее, эфирные масла терпеноидов биосинтезируются посредством мевалонатного пути, включающего дериватизацию и полимеризацию 5-членных изопреновых алкенов из изопренилдифосфата (IPP) и диметилаллилдифосфата (DMAPP). Следовательно, изопреновые звенья объединяются для образования терпенов, включающих повторяющиеся углеродные цепи, кратные пяти. В настоящее время известно более 30 000 терпеноидов, выделенных из растений, микроорганизмов и животных, многие из которых содержатся в эфирных маслах. В этом наборе известных терпеноидов есть несколько химических классов, разделенных на группы по размеру и элементному / структурному составу. Известно, что монотерпены включают 25 различных классов терпеноидов, 147 классов существуют для сесквитерпенов, а дитерпены относятся к 118 классам [21].
Эфирные масла также можно описать и до некоторой степени классифицировать по их аромату. Масла с преобладанием монотерпеновых компонентов можно охарактеризовать как «верхнюю ноту», потому что аромат резкий и ощущается сразу после нанесения. Хорошо известные верхние ноты: цитрусовые (Citrus bergamia Risso) и имбирь (Zingiber officinale Roscoe). Такие масла верхней ноты содержат мелкие компоненты, которые быстро испаряются. Однако, хотя поначалу это не заметно, средние ноты (ноты сердца) и базовые ноты (нижние ноты) сильно влияют на эстетику запаха и маскируют резкость верхних нот. Кроме того, они воспринимаются сразу после того, как рассеиваются верхние ноты. Хорошо известными маслами сердечных нот являются масла лаванды (Lavandula angustifolia Mill.) и розы (Rosa damascena Mill.), которые, по описанию, обладают более мягким или округлым запахом. Эти масла состоят из компонентов, которые немного больше простых монотерпенов, таких как монотерпенолы и сложные эфиры. Масла, в которых преобладают сесквитерпены, обычно считаются производящими базовый запах. Базовые ноты обычно считаются богатыми, землистыми и глубокими, наиболее распространенным примером является мускус (Angelica archangelica L.). Обычно аромадизайнеры и парфюмеры стремятся комбинировать ноты, чтобы добиться оптимизации и сочетания ингредиентов, которые радуют чувства [41].
Возвращаясь к концепции биосинтеза эфирных масел, микробные эндофиты также могут играть значительную роль в их синтезе. Хотя еще не так много известно о том, как именно эндофиты могут участвовать в этом процессе, ясно, что, по крайней мере, такие эндофиты могут дать окончательное химическое изменение до того, как эфирное масло станет конечным продуктом. Такие микробные реакции называются биотрансформацией, которая представляет собой процесс, который можно использовать in vitro для создания менее распространенных компонентов из соединений-предшественников, которые доступны в изобилии. Уже известно, что эндофиты ответственны за биосинтез множества натуральных продуктов, некоторые из которых обеспечивают защиту от травоядных или других конкурирующих растений, таких как цитотоксический хинолиновый алкалоид камптотецин, биосинтезируемый de novo (с самого начала) эндофитным грибком Fusarium solani и накапливается в тканях Camptotheca acuminata Decaisne [42].
В случае бактериальных эндофитов становится все более очевидным, что они влияют на физиологию растений, поглощение питательных веществ и энергию роста растений через биосинтез фитогормонов, таких как этилен, индол-3-уксусная кислота и ацетоин, 2,3-бутандиол [43] . Были выделены такие бактериальные эндофиты из Lavandula angustifolia Mill, и было показано, что они секретируют метаболиты, которые ингибируют патогены человека. Из-за сходства ингибирования, продемонстрированного между эндофитами и эфирным маслом, было высказано предположение, что эндофиты могли участвовать в синтезе эфирного масла. Однако химические характеристики метаболитов эндофитов в этом исследовании не проводились [43]. В новаторском исследовании грибковых эндофитов Mentha piperita L. было продемонстрировано, что сам грибной организм биосинтезирует все компоненты эфирного масла de novo в ризосфере растения, хотя состав компонентов регулируется взаимодействием растений. [44].
У Lamiaceae секреторные структуры эфирного масла, называемые железистыми трихомами, хорошо изучены и считаются местом биосинтеза, накопления и секреции эфирных масел [45]. Очень мало исследований было посвящено выявлению возможных эндофитных бактериальных сообществ, которые могут быть вовлечены в этот биосинтетический путь и в каком качестве.
В настоящее время в индустрии ароматизаторов насчитывается около 100 молекул, полученных в результате ферментативных или микробных процессов [46]. Это связано с тем, что ингредиенты, полученные в результате преобразования натурального сырья с помощью микробных или ферментативных процессов, могут быть обозначены как «натуральные» в соответствии с законодательством Европы и США. Конечно, такие ароматизирующие соединения можно было бы получить более дорого из растений или сельскохозяйственных культур. В классической индустрии ароматизаторов преобладающим источником ингредиентов были растения, но по мере развития синтетической химии растительные источники устарели, особенно в более крупных отраслях, где сокращение затрат имеет приоритет. Эта фаза в конечном итоге сошла на нет, когда «натуральные» продукты стали привлекать значительно более высокие рыночные цены до двух порядков. В то время исследования микробных биотрансформаций начали расширяться, пока в отрасли не стали преобладать ароматизаторы микробного происхождения. Рост биотрансформации и de novo биосинтетических продуктов микробного происхождения в области промышленных ароматизаторов обязан своим успехом биологическому или «естественному» происхождению продуктов, которое дает такие ароматизаторы по значительно более низкой цене, чем классические методы производства [46]. Исчерпывающий обзор микробных трансформаций представлен Нома и Асакава [47] для биотрансформации монотерпенов и Асакавой и Нома [48] для сесквитерпенов.
Хотя такие микробные процессы доминируют на рынке, где востребованы отдельные изолированные ароматические соединения, цельные эфирные масла по-прежнему в основном получают из классического сельского хозяйства или сбора дикорастущих растений. Однако, стремясь снизить затраты и проблемы традиционного сельского хозяйства и уменьшить зависимость от сбора дикорастущих растений, исследователи предпринимают усилия по развитию отрасли производства эфирных масел, в которой участвуют крупномасштабные культуры тканей растений в попытке создать подходящие альтернативы производству эфирных масел [49]. В таком большом масштабе эта технология все еще находится в зачаточном состоянии. Неизвестные переменные, такие как роль эндофитов и их выживаемость в этих культурных средах, должны быть приняты во внимание. Кроме того, если показано, что эфирные масла, биосинтезируемые соответствующим «растением», синтезируются de novo из бактериальных эндофитов, такое культивирование растений будет пустой тратой ресурсов, если только синтетические предшественники не производятся самим растением.
1.5. Эфирные масла в сельском хозяйстве
Когда дело доходит до обсуждения эфирных масел в сельском хозяйстве, основное внимание, конечно же, уделяется максимизации урожая эфиромасличных видов растений, при этом производя эфирное масло в соответствии с опубликованными стандартами. Существует минимальное обсуждение того, как такие масла могут быть использованы в более широком смысле в самом сельском хозяйстве. Возможно, это связано с предполагаемыми затратами на применение эфирных масел в качестве пестицидов или гербицидов. Однако можно возразить, что снижение популярного спроса на синтетические ароматизаторы в пищевых продуктах для людей может означать, что такие продукты найдут применение в сельском хозяйстве в качестве замены гораздо менее популярных пестицидов и гербицидов. Если сельское хозяйство совпадает с органическими методами производства, такие соединения могут быть получены из бактериальных или грибковых культур.
Подавляющее большинство исследований эфирных масел сегодня ограничено фармакологической лабораторией или лабораторией по открытию новых лекарств. Возможно, это вызвано финансовым стимулом со стороны крупных фармацевтических фирм, которые стремятся выкупить патенты на биологически активные вещества, с обещанием огромной финансовой выгоды держателю патента. С другой стороны, это может быть следствием тяготения к популярной науке, которая стремится отмечать узкоспециализированные исследования и чисто академические открытия. Однако, как объяснил Murray, впоследствии были упущены вопросы, имеющие более практическое значение:
«Академические исследователи, как правило, больше озабочены поддержанием строгости науки, о чем судят их коллеги в журналах и материалах конференций, а не исследованиями, которые непосредственно способствуют использованию эфирных масел и развитию отрасли».
[50]
Преимущество использования летучих «натуральных» гербицидов в полевых условиях заключается в том, что они не сохраняются и не становятся частью послеуборочного продукта, а в некоторых случаях продукт может продаваться как «органический» и, следовательно, привлекать более высокую цену. Хотя это может быть преимуществом, необходимо предпринять усилия для увеличения времени пребывания во время фазы роста, используя поверхностно-активные вещества или технологию инкапсуляции. Возможность использования эфирных масел в качестве гербицидов уже была продемонстрирована, особенно в тех случаях, когда прорастание семян было подавлено, но, опять же, движение к использованию такой технологии на обширных фермах минимально из-за затрат. Еще одно преимущество использования летучих веществ в качестве дополнения к гербицидам состоит в том, что они могут облегчить опыление, действуя как определенные желательные аттрактанты насекомых, одновременно отталкивая другие [51].
Эфирные масла также могут использоваться в сельском хозяйстве, действуя как противомикробные соединения. Недавно законодательство ЕС запретило использование антибиотиков при выращивании животных на убой. Отчасти это происходит из-за растущей устойчивости патогенов [51], но в первую очередь это касается качества мясных продуктов в конце использования. В этом отношении наилучшей альтернативой являются натуральные продукты, особенно эфирные масла, поскольку они служат и другим целям. В сочетании с преимуществами, полученными при использовании эфирных масел в качестве противомикробных средств, они также действуют как стимуляторы аппетита и как стимуляторы выработки слюны, желудочного и панкреатического сока [52].
Антимикробная активность эфирных масел также может быть использована для борьбы с грибковой или бактериальной порчей продуктов, готовых к хранению, или для обработки фруктов и овощей на этапах сбора урожая. Проблема при использовании этой методологии заключается в том, что концентрации, требуемые для достижения такого ингибирования, могут добавлять другие ароматизаторы и ароматизаторы, незнакомые продукту [51]. Однако в последних инновационных технологиях используется низкое давление и поток теплого воздуха как средства для значительного усиления антимикробной активности эфирных масел, применяемых для фруктов и овощей [53].
Возвращаясь к оптимизации сельскохозяйственного производства эфирных масел, большое внимание было обращено на генетическую модификацию для повышения урожайности. Традиционно оптимизация урожайности была сосредоточена на онтогенезе растений, что означает отбор на определенной стадии роста или для конкретных органов, клеточных или тканевых структур растения. Предлагаемая биотехнологическая инновация включает модификацию растений для оптимизации фенотипических признаков, которые поддерживают производство эфирного масла, таких как трихомы или эпидермальные волоски и так далее [54]. Обычно, когда генная инженерия растений направлена на активизацию пути биосинтеза, ограничивающим фактором является соединение-предшественник, что усложняет задачу. В то время как некоторые пытались воссоздать весь путь биосинтеза терпеноидов в рекомбинантных микробах, тем самым преодолевая поставку предшественников путем добавления их вручную после биосинтеза у другого микроба [55], следующая проблема заключается в использовании микроба, обладающего устойчивостью к целевому соединению. На практике ответом является микроб, полученный из самого растения [56].
В свете большего интереса и более легкого обращения с микробами в качестве биосинтетических фабрик, в частности легкости, с которой гены могут быть клонированы из растений в микробы, нет большого интереса к модификации самих растительных организмов для увеличения производства эфирного масла. Хотя поначалу это может показаться угрозой для сельскохозяйственной отрасли, возможность использования одного микроба для биосинтеза сложной смеси компонентов, идентичных эфирному маслу, все еще недоступна. И наоборот, использование набора микробов для индивидуального биосинтеза ингредиентов и, следовательно, создания смеси, вероятно, не встретит одобрения подавляющего большинства людей, которым нравится иметь эфирные масла растительного происхождения.
2. Фармакология широко известных компонентов эфирных масел.
2.1. Тестирование биологической активности.
Эфирные масла могут характеризоваться высокой или низкой биологической активностью, но это субъективное описание имеет относительное значение, исключительно в контексте эфирных масел. Ингибирующая концентрация эфирного масла с «сильным» противомикробным действием необязательно может быть такой же низкой, как у антибиотика, отпускаемого без рецепта. Следовательно, использование такой терминологии для описания биологической активности эфирных масел всегда должно дополняться значениями данных, чтобы показать контекст.
Стандартизация методов биологического тестирования все еще развивается, а это означает, что результаты, описанные в литературе, не обязательно могут быть легко воспроизводимыми. В этом отношении наиболее часто описываемая в литературе биоактивность связана с антимикробной, противовирусной, анальгезирующей, противоопухолевой, противовоспалительной, пищеварительной, семиохимической активностью, улавливающей свободные радикалы. Методология этих тестов будет кратко описана здесь [57,58].
Хотя в литературе продемонстрирован ряд видов биологической активности, наиболее часто упоминаемая активность эфирного масла - это его антимикробная активность. Возможно, это связано с тем, что тестирование на чувствительность к противомикробным препаратам - это простой, недорогой и понятный метод. С другой стороны, растущая популярность эфирных масел как противомикробных веществ может быть связана с опасениями по поводу растущей устойчивости патогенных организмов к основным антибиотикам.
Подобно обобщениям о токсичности эфирного масла для человека, подход, основанный на компонентах, может предоставить простое руководство для прогнозирования антимикробной активности эфирного масла, но фактическая активность не может быть известна до тех пор, пока образец не будет протестирован, и даже тогда результаты могут быть удивительными. Это простое обобщение дает наивысший приоритет (наивысшую активность) компонентам эфирного масла с высоким липофильным характером в углеводородном скелете, но высоким гидрофильным характером по его функциональной группе, с ранжированием следующим образом: фенолы> альдегиды> кетоны> спирты> сложные эфиры> углеводороды [ 58].
Для проверки антимикробной активности в основном используются два метода: дисковая диффузия и анализы разбавления бульона. Разновидностью диско-диффузионного анализа является лунно-диффузионный анализ, но оба они дают результат одного и того же типа, что является более качественным анализом ингибирования. Дисковая диффузия выполняется на чашке с агаром, в то время как разбавление бульона выполняется в питательном бульоне. Вкратце, в микробиологии чашки с агаром обычно используются в качестве среды для роста бактериальных или грибковых организмов (рис. 6А). Сам агар представляет собой студенистое вещество, обнаруженное еще в 1650–60 гг. нашей эры в Японии, происходящее из клеточных стенок водорослей. Его основная цель в чашке с агаром - действовать как отвердитель в обогащенной питательными веществами среде, чтобы создать плоскую влажную, богатую питательными веществами поверхность для легкого манипулирования растущими колониями микробов или грибов. В диско-диффузионном анализе эта поверхность полностью покрыта тонким слоем микробов, и на поверхность кладут бумажные диски. На каждый бумажный диск вносится обработка, в данном случае объем эфирного масла. Если эфирное масло оказывает ингибирующее действие на выбранный микроб, вокруг диска образуется зона просвета, представляющая диффузию антимикробного вещества через агар и внутрь него (рис. 6А) [59].
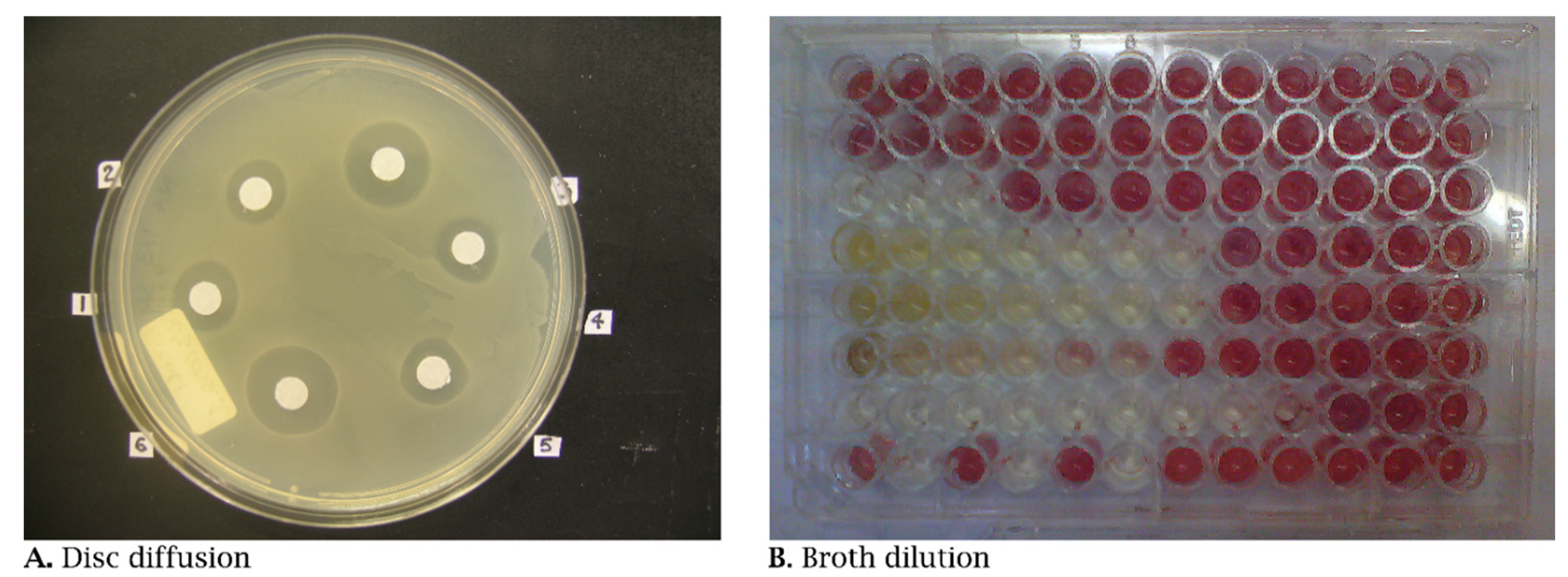
Рисунок 6. Примеры распространенных методов, используемых для тестирования на противомикробные препараты. Субъективная антимикробная активность демонстрируется диско-диффузионным анализом (A), а средние ингибирующие концентрации (MIC) рассчитываются из анализа разбавления бульона, проводимого в 96-луночном микротитровальном планшете, с колориметрическим детектированием роста микроорганизмов, красный цвет указывает на рост микроорганизмов (B ).
Метод дисковой диффузии не считается точным методом определения репрезентативной ингибирующей концентрации. Этот метод используется просто как инструмент первичного скрининга перед применением более строгого метода, которым будет анализ разбавления бульона. Анализ разбавления бульона почти всегда проводят в 96-луночном микротитровальном планшете (рис. 6В), где противомикробное вещество смешивают с богатым питательными веществами бульоном и последовательно разбавляют до постепенно более низких концентраций (т. Е. 5%, 2,5%, 1,25% и т.д.), обычно двигаясь слева направо. В анализах эфирных масел обычной практикой является добавление чего-либо, способствующего образованию эмульсии, из-за обычного разделения фаз масла и воды. В некоторых случаях используется небольшое количество агара, чтобы сделать бульон «неаккуратным» [60], но чаще используется детергент, такой как Tween 20 [61].
Хотя рост бактерий можно визуализировать по помутнению бульона, обычно перед регистрацией результатов в среду добавляют метаболизируемую соль (p-iodonitrotetrazolium). Соль превращается в окрашенное соединение живыми бактериями, и результаты можно прочитать по цвету (рис. 6В). Концентрация, при которой цвет не наблюдается, указывается как средняя ингибирующая концентрация (МИК). При такой концентрации неясно, был ли организм подавлен или уничтожен. Однако, если бульон из этой лунки разливают на чашку с агаром и на агаре не растут никакие организмы, то эту концентрацию также можно указать как среднюю бактерицидную концентрацию (МБК). Чем ниже MIC или MBC, тем выше активность масла [61].
Проблема, с которой часто сталкиваются в экспериментах по разбавлению бульонов с использованием эфирных масел, заключается в том, что они постоянно испаряются. Это приводит к снижению измеряемых концентраций и приводит к фракционированию масел из-за того, что некоторые компоненты имеют более высокое давление пара, чем другие. Возможно, более проблематичным является распространение компонентов из одной скважины в другую, что может создавать видимость синергетических или антагонистических взаимодействий, что опять же снижает воспроизводимость результатов. Хотя использование парафильма для фиксации всех летучих веществ в 96-луночном планшете имеет преимущество в замедлении испарения эфирных масел во время эксперимента [62], недостатком является то, что синергические или антагонистические взаимодействия могут быть усилены. Таким образом, более надежный метод заключается в использовании стерильного пластикового липкого листа, который закрывает все лунки по отдельности [63].
В обоих случаях авторы часто пытаются сообщить свои данные со средней и стандартной ошибкой, но из-за изменчивости и недостаточной воспроизводимости это вводит в заблуждение. Это связано с тем, что исходная концентрация будет влиять на концентрацию паров эфирных масел в атмосфере, которая может влиять на наблюдаемый МПК. Кроме того, данные MIC являются порядковыми, что требует другого типа статистического анализа. Как правило, если конкретное значение MIC может быть повторено по крайней мере 3 из 4 раз, оно считается значимым и может быть сообщено.
Хотя использование липкого стерильного пластикового листа для закрытия всех лунок 96-луночного микротитровального планшета можно считать наиболее надежным с точки зрения воспроизводимости результатов, все еще существует проблема перевода результатов, достигнутых в экспериментах (а именно, in vitro ) к действительным эффектам при применении на животных или людях (а именно, in vivo). С этой проблемой in vitro по сравнению с in vivo сталкиваются все биологические тесты, а не только антимикробные тесты.
Помимо антимикробных анализов, в других биологических тестах обычно используются животные модели или анализы культур клеток или тканей, где известные пути к патогенезу подавлены. Например, в воспалительной модели можно индуцировать ряд известных воспалительных путей с помощью анализа (или набора), и можно ввести тестируемое вещество (эфирное масло), чтобы попытаться подавить транскрипцию или активность соответствующих факторов. Некоторые хорошо известные воспалительные пути включают NO (оксид азота), TNF-α или PGE2 и это лишь некоторые из них [57]. Интересной разработкой для тестирования пути TNF-α является трансфекция линии моноцитарных макрофагов мыши RAW264.7 пДНК, которая кодирует репортерные белки (белки, которые могут указывать на результат эксперимента) [64]. В одном конкретном эксперименте активация NF-κB (которая приводит к продукции TNF-α) может быть визуализирована посредством одновременной транскрипции того же самого фосфоресцентного белка люциферазы, который более известен у видов светлячков (Photinus pyralis). Клетка «светится», когда запускается липополисахаридом, сигнализирующим о воспалении. Если клетка не светится, возможно, произошло ингибирование пути TNF-α [65].
В некоторых тестах на противовирусную активность клетки млекопитающих трансфицируют вирусом, и выживаемость клеток определяется любым из ряда колориметрических или проточно-цитометрических методов [66]. В самом базовом тесте на противораковую активность иммортализованные раковые клетки выращивают в культуре и исследуют на выживаемость или подавление в условиях соответствующего лечения [67]. Что касается антиоксидантной активности или активности по улавливанию свободных радикалов, окрашенные свободные радикалы можно уменьшить обработкой и сделать невидимыми невооруженным глазом, при этом результаты количественно оцениваются с помощью спектрофотометра в видимом спектре [68]. Вариант этого состоит в том, что свободный радикал при восстановлении окрашивается, что также измеряется с помощью спектрофотометра [69]. Для пищеварительной активности, связанной с блокировкой Ca2 + -зависимых ионных каналов, сегмент слепой кишки из кишечника животного может быть помещен в буфер и присоединен к сборке, которая измеряет спазмолитическую активность, связанную с сокращением слепой кишки. Избыток того или иного иона в буфере свидетельствует о блокировке канала [70].
Показано, что при семиохимической активности ряд видов насекомых отталкивается определенным лечением или эфирным маслом. Например, австралийское эфирное масло Eremophila mitchellii Benth оказалось сильным репеллентом против термитов [56]. Распространенной моделью на животных, используемой для демонстрации местных анальгетических свойств эфирного масла, является «тест с горячей пластиной», когда реакция мыши или крысы после того, как она поместила лапу на горячую пластину, может быть отсрочена обработкой определенным эфирным маслом [71].
Анальгезия также обычно связана с активностью центральной нервной системы, но в этом отношении ее называют антиноцицептивной активностью. Антиноцицептивная активность может быть более широко связана с психологическими эффектами, когда другие болезненные состояния включают депрессию, тревогу или истерию. Антиноцицептивная активность не рассматривается как биологическое свойство как таковое [57], но, тем не менее, имеет важное значение для биологической активности эфирных масел. В методах, обычно используемых для измерения таких эффектов, широко используются модели на животных, на которых вызываются боль или кишечные корки в результате внутрибрюшинных инъекций. Лечение направлено на уменьшение этих наблюдаемых эффектов [57].
Всесторонний обзор результатов такой биологической активности в контексте эфирных масел предоставлен Buchbauer [57] и Koroch et al. [58]. В связи с этим из-за чрезвычайно большого количества доступных сейчас данных о биологической активности, в настоящее время происходит смена парадигмы в биологических исследованиях эфирных масел. Растущее беспокойство о переводе результатов in vitro на использование in vivo вызвало ряд экспериментов, направленных на изменение применения эфирных масел для воспроизведения результатов in vitro на модели человека или животного.
Особое значение для эфирных масел имеют проблемы испарения, растворимости и абсорбции. В настоящее время проводится несколько исследований, направленных на улучшение инкапсуляции эфирных масел, которые могут включать инкапсуляцию эфирных масел в различные субстраты, такие как липосомы, покрытые хитозаном, для замедления испарения и повышения антимикробной активности [72]. Другой подход включает улавливание эфирных масел растворенными циклодекстринами, которые можно использовать в качестве кормовой добавки для маскировки вкуса, а также для замедления испарения эфирных масел и, следовательно, увеличения срока хранения мазей и кремов для местного применения [73]. Эксперименты по проникновению, в которых эфирные масла действуют в качестве носителя для другого противомикробного препарата, также были проведены с продемонстрированным успехом, что может быть связано с взаимодействием масел с жидкими кристаллами липидов кожи [57]. Можно утверждать, что такие инновационные методы будут составлять большую часть будущего биологических исследований эфирных масел.
2.2. Фармакологические свойства всемирно признанных эфирных масел
В конце 1800-х годов, когда химия эфирных масел только зарождалась, химический характер эфирных масел передавался в широких родовых категориях, таких как терпеноиды или фенилпропаноиды, или использовалась иная специальная химическая номенклатура. Терминология для выражения характера эфирных масел была позже расширена и улучшена после предложения Belaiche о назначении химических классов, которые можно было бы использовать для прогнозирования биологической активности самих масел [2]. Это произошло, когда известные французские авторы Pierre Franchomme и Daniel Penoel опубликовали книгу L’Aromathérapie éxactement [2], которая предоставила основу для классификации эфирных масел, которая используется по сей день. Franchomme и Penoel предоставили список этих типов в соответствии со структурным функционалом, которые перечислены в таблице 2 [2]. Некоторые из этих фармакологических групп не входят в состав эфирных масел в качестве общих компонентов, и они выделены курсивом, чтобы помочь читателю. Наглядное представление общих групп представлено на рисунке 7.
| Типы эфирных масел, описанные Franchomme и Penoel | ||
|---|---|---|
| Alcohols and Phenols (hydroxyl group) | Coumarins | Ether-Oxides |
| Methoxycoumarins | Acetophenones | Hydroquinones |
| Non-Terpenoid Hydrocarbons | Acids | Oxides |
| Terpenoid and Non-Terpenoid esters | Ketones; | Lactones |
| Phenol and Methyl-Ether | Phthalides | Aldehydes |
| Bi- or Multifunctional Compositions | Acids and Esters | Terpenes (hydrocarbons) |
| Nitrogen Compositions | Sulfur Compounds | - |
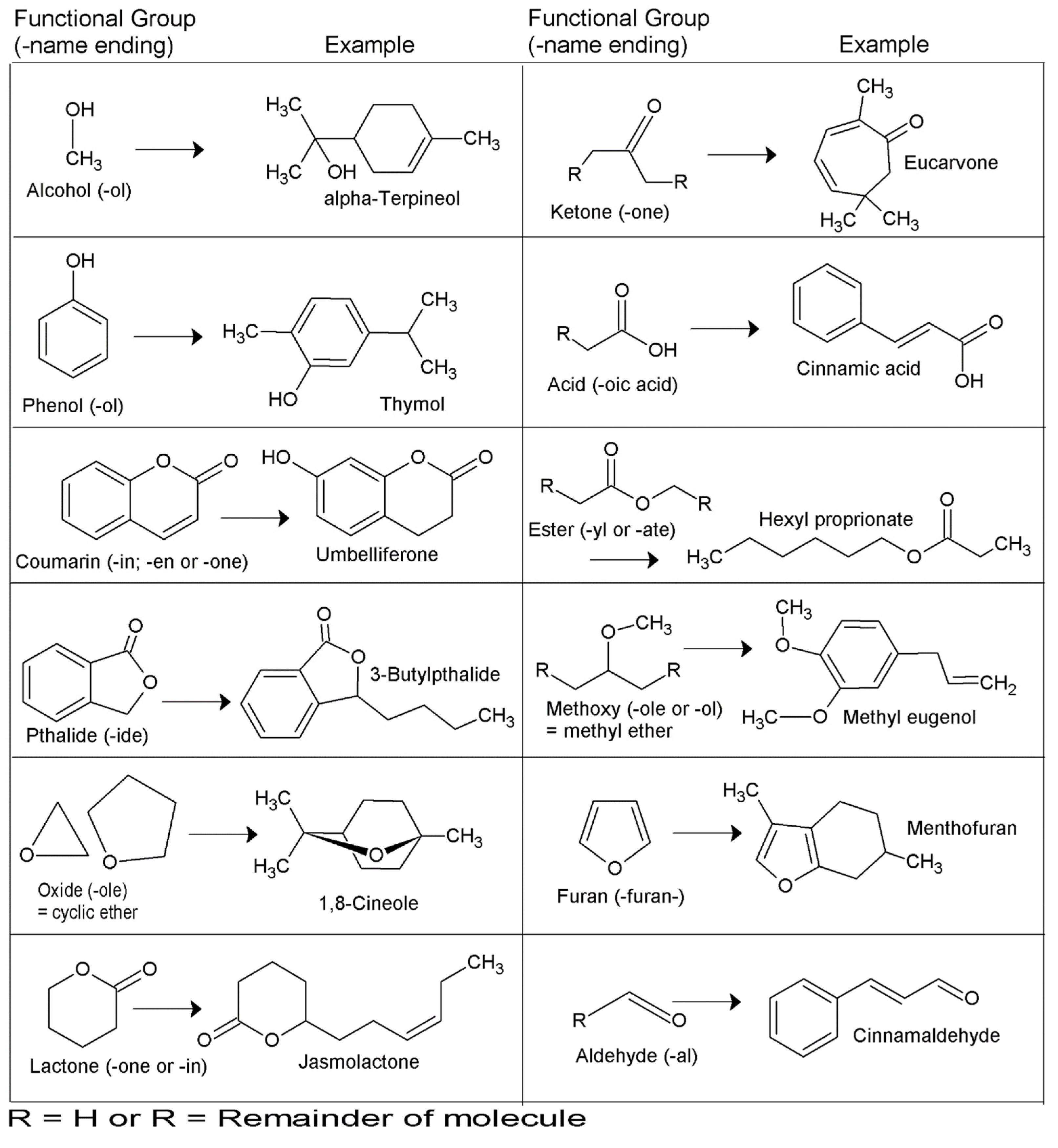
Рисунок 7. Примеры общих функциональных групп.
Фармакологически значимые функциональные группы эфирных масел имеют как терпеноидное, так и нетерпеноидное происхождение, если не указано иное. Что касается коммерчески значимых эфирных масел, монотерпеновые углеводороды, такие как α-пинен (2), лимонен (3) или ρ-цимен (4), являются основными компонентами грейпфрута (Citrus paradise Macfad: Rutaceae), сосны (Pinus pinaster Aiton: Pinaceae), ягоды можжевельника (Juniperus communis L .: Cupressaceae) и ладан (Boswellia carteri Birdw: Burseraceae) соответственно. S-энантиомер лимонена (3) наиболее известен из Citrus, тогда как R-энантиомер известен из Turpentine [26].
Такие эфирные масла с преобладанием монотерпенов обладают выраженным противовирусным действием и сушат кожу [2]. Было продемонстрировано, что фенилуглеводород ρ-цимол (4) обладает сенсибилизирующим действием на кожу, поэтому эфирные масла, богатые ρ-цимолом, избегают при местном применении [40]. Фенолы также могут демонстрировать такие эффекты вместе с гепатотоксичностью при приеме внутрь в высоких или умеренных концентрациях в течение длительного периода времени [2].
Что касается сесквитерпеновых углеводородов, β-кариофиллен (5) из черного перца и хамазулен (6) из немецкой ромашки (Chamomilla recutita (L.) Rauschert: Asteraceae) [40]. Азулен-сесквитерпены, такие как хамазулен (6) или гваязулен из Callitris intratropica R.T.Baker and H.G.Sm (Cupressaceae), при наличии в достаточных концентрациях ответственны за синий цвет своих соответствующих эфирных масел [40,74].
Известны монотерпенолы, такие как линалоол (7) из лаванды (Lavandula angustifolia Mill: Lamiaceae), ментол (8) из перечной мяты (Mentha piperita L .: Lamiaceae) или α-терпинеол (9) из чайного дерева (Melaleuca alternifolia Cheel: Myrtaceae) применяются для легкого обезболивающего эффекта при местном применении [40]. Кроме того, линалоол (7) также может вызывать седативный эффект [75]. Строго в контексте эфирных масел монотерпеновые спирты обычно обладают сильным ингибирующим действием против бактериальных патогенов [2]. В контексте фальсификации эфирных масел R-энантиомер линалоола (7) преобладает в масле бергамота, поэтому о его фальсификации свидетельствует присутствие S-энантиомера. Обратное верно для кориандрового масла, которое имеет избыток S-энантиомера [26].
Хорошо известными сесквитерпенолами являются α-бисаболол (10), опять же из немецкой ромашки, α-эвдесмол (11) из можжевельника виргинского (Juniperus virginiana L .: Cupressaceae) или β-санталол (12) из индийского сандалового дерева (Santalum album L .: Santalaceae) . Сесквитерпенол α-бисаболол и сесквитерпен хамазулен (6) связаны с противовоспалительной активностью, особенно α-бисаболол [40]. (-) - энантиомер α-бисаболола является отличительной чертой ромашкового масла (Chamomilla recutita (L.) Rauschert: Asteraceae) [26].
Блокирование нейрональных Са2 + -каналов α-эудесмолом in vitro (11) было связано с потенциальными психоактивными эффектами [76]. Это может иметь значение в отношении неофициальных отчетов об эфирном масле можжевельника виргинского, связанном с улучшением памяти и творческих способностей [77]. Психоактивные и физиологические эффекты, согласующиеся с седативным действием, наблюдались при трансдермальном всасывании индийского сандалового дерева (S. album L.) с активностью, приписываемой α-санталолу [78]. (-) - энантиомер β-санталола (12) является характерным соединением для масла сандалового дерева (S. album L.). Масло сандалового дерева также связано с потенциальным ингибированием вируса простого герпеса [40].
Другие хорошо известные примеры химических групп, описанных Franchomme и Penoel (Таблица 2), включают фенолкарвакрол (13) из орегано (Origanum vulgare L .: Lamiaceae), который потенциально может быть вовлечен в повреждение печени, наряду с множеством других фенолов и, более конкретно, фенилпропаноиды, такие как вышеупомянутый карвакрол (13) и потенциально гепатотоксичный сафрол (14) и метилэвгенол (15), которые, как известно, доступны с высокими выходами из различных видов Australian Zieria (Rutaceae) [79] и необычный и редкий хемотип Eremophila longifolia F.Muell (Scrophulariaceae) [22,62], как упоминалось ранее.
Примером хорошо известного компонента из класса альдегидов является цитронеллаль (16) из Eucalyptus citriodora Hook (Myrtaceae), который используется в качестве репеллента от насекомых с противомоскитной активностью [80]. (-) - энантиомер цитронеллаля получают в энантиочистой форме из масла мелиссы (Melissa officinalis L.), что делает его полезным для установления подлинности [26].
Камфора (17) - самый известный пример кетона, который является основным компонентом эфирных масел испанского хемотипа (CT1) розмарина. Хотя к использованию камфары (17) относятся с подозрением, после того, как исследования продемонстрировали потенциальную судорожную активность и повреждение печени / центральной нервной системы, хемотип розмарина, богатый камфарой (17) и α-пиненом (2), продолжает использоваться в качестве линимента. при мышечных болях [40]. Камфора (17) представляет собой кетон спирта борнеола (18), который в большом количестве встречается в конкретном хемотипе эфирного масла австралийского вида E. longifolia, который продемонстрировал умеренную антимикробную активность [62].
Поскольку кислоты более растворимы в воде, они не часто становятся частью эфирного масла. Примером этого является группа босвеллиевых кислот различных видов ладана (Boswellia spp.). Небольшие количества босвеллиевых кислот присутствуют в эфирных маслах, но большинство растворяется в гидрозоле. Таким образом, масла ладана, полученные с использованием сверхкритической экстракции CO2, имеют гораздо более высокие концентрации босвеллиевых кислот [40].
Кислоты и спирты обычно являются предшественниками сложных эфиров, а когда сложные эфиры образуют замкнутые кольца, они становятся лактонами [17]. Обычно, когда спирты этерифицируются уксусной кислотой или другой молекулой с большей массой, полученные сложные эфиры называют в соответствии с исходным спиртом, таким образом, линалоол (7) становится линалилацетатом (19), борнеол (18) становится борнилацетатом (20) и фенхол (21) превращается в фенхилацетат (22). Кетон фенхола - фенхон (23).
Линалилацетат (19) - еще один из основных компонентов масла лаванды и, кроме того, важный компонент эфирного масла шалфея мускатного (Salvia sclarea L .: Lamiaceae). Линалилацетат был связан с ранее упомянутой анальгезией вместе с линалоолом (7) в масле лаванды [40]. Масло, богатое фенхил- (22) и борнилацетатом (20), получено из масла австралийского вида Eremophila bignoniiflora F.Muell (Scrophulariaceae), и эти компоненты, вероятно, ответственны за продемонстрированную умеренную или высокую активность против дрожжей Candida albicans и бактерии Staphylococcus epidermidis [81]. Кроме того, E. bignoniiflora использовалась в традиционных медицинских целях австралийскими аборигенами для лечения головных болей с помощью летучих газов и экстрактов листьев в качестве слабительного. Schnaubelt [37] перечисляет эфирные масла, богатые сложными эфирами, как обладающие спазмолитическим действием, а также эффективные при лечении заболеваний центральной нервной системы и стресса. Таким образом, эфирные масла из E. bignoniiflora, богатые сложными эфирами, могли быть широко использованы в традиционных медицинских целях.
Другой хорошо известный эфир, составляющий примерно 98–99% всего эфирного масла грушанки (Gaultheria procumbens L: Ericaceae), - это метилсалицилат (24), который, как считается, обладает обезболивающим, противовоспалительным и противораздражающим действием, сравнимым с аспирином. Метилсалицилат часто используется в качестве положительного контроля в различных фармакологических тестах на анальгезию и противовоспалительную активность [82,83].
В эфирных маслах чрезвычайно редко эфир встречается в какой-либо другой форме, кроме как в виде метоксигруппы или замкнутого в кольцевую структуру (циклический эфир). Что касается метоксигрупп (метиловых эфиров) в эфирных маслах, они обычно встречаются в виде фениловых эфиров, таких как фенилпропаноиды эвгенол (25), известные из масла почек гвоздики (Syzygium aromaticum L: Myrtaceae) в концентрациях до 75%, и метилхавикол (эстрагол) (26) из базиликового масла с острова Коморо (Ocimum basilicum L: Lamiaceae) составляет примерно 85% от общего количества. В целом такие эфиры обычно связаны с психотропными эффектами, которые могут привести к смерти, если принимать их в высоких дозах. Наиболее известными примерами из них являются фенилпропаноиды, миристицин (27) и элемицин (28), высококонцентрированные в эфирном масле, полученном из семян мускатного ореха (Myristica Fragrans Houtt: Myristaceae) [40,84,85].
Когда простые эфиры встречаются в замкнутых циклических структурах, они называются оксидами. Возможно, наиболее известным из них является 1,8-цинеол (29), также известный как эвкалиптол. В австралийской флоре виды Eucalyptus - не единственные, демонстрирующие высокий выход этого соединения, поскольку 1,8-цинеол (29) также содержится в высоких концентрациях в эфирном масле многих других эндемичных родов, включая Prostanthera spp. (Lamiaceae) вместе с множеством других сесквитерпенолов. Такие виды, как P. ovalifolia R.Br., P. rotundifolia R.Br., P. caerulea R.Br., P. lasianthos Labill., P. cineolifera R.T.Baker, H.G.Sm и P. incisa R.Br. имеют высокие концентрации 1,8-цинеола (29) в эфирных маслах [45,86,87,88,89]. Поскольку 1,8-цинеол (29) оказывает отхаркивающее действие, неудивительно, что большое количество растений, богатых этим соединением, использовались этномедицинскими средствами для снятия отеков у больных кашлем и простудой.
Лактоны входят в состав многих эфирных масел [21]. Лактоны образуются в результате реакции внутримолекулярной этерификации, когда алифатический спирт соединяется с кислотой и замыкается в соответствующий циклический сложный эфир [40]. Лактоны названы в честь молочной кислоты (C3H6O3) и являются производными от нее. Обычно они встречаются в пяти- или шестичленных гетероциклических кольцах в насыщенных или ненасыщенных формах, связанных с карбонильной группой. Лактоны, входящие в состав пятичленных колец, называются γ-лактонами; те, которые встречаются в шестичленном кольце, они называются δ-лактонами [21], а те, что встречаются в четырехчленном кольце, как β-лактоны [21].
Входящие в состав гамма-лактоны, некоторые с ароматом персика, содержатся в пажитнике, кофе и саке; представители δ-лактонов содержатся в сыре, фруктах и молочных продуктах, обычно со сливочно-кокосовым или персиковым запахом. Лактоны с более крупными углеродными кольцами содержатся в эфирных маслах семян амбретты или корня дягиля. Дягиль также содержит фталиды, которые представляют собой лактон 2-гидроксиметилбензойной кислоты. Фталиды ограничиваются семейством Apiaceae, как правило, сельдереем, любистоком и дягилем [21].
Лактоны также продемонстрировали возможные отхаркивающие эффекты, но пока не ясно, следует ли противопоказать их местное применение, поскольку некоторые исследования выявили возможность возникновения сенсибилизации кожи. Несмотря на это, лактоны также продемонстрировали высокую активность in vitro, совместимую с противовоспалительным действием, что означает, что эфирные масла, богатые лактоном, могут быть подходящим образом использованы для местного применения для лечения воспалений [40]. В этом контексте, учитывая широко распространенную хроническую природу воспалительного заболевания желудка, возможно, стоит изучить потенциал лактонов для лечения воспаления кишечника или пищеварительного тракта.
Когда ароматический лактон находится рядом с бензоидным фрагментом, он становится кумарином. В своей простейшей структурной форме он просто называется кумарином (30), который является основным пахучим соединением, ответственным за аромат свежескошенного сена [90]. Возможно, наиболее известным кумарином является фуранокумарин бергаптен (31), содержащийся в масле бергамота (Citrus bergamia Risso: Rutaceae), а также в австралийских видах, таких как Philotheca trachyphylla (F.Muell) Paul G. Wilson (Rutaceae) (ранее Eriostemon) [91]. Бергаптен (31) обладает УФ-сенсибилизирующим эффектом, связываясь с меланином в коже при местном применении на солнце [40]. Это усиливает действие солнечных лучей. Интересно, что масло, богатое бергаптеном (31), скорее всего, является следствием метода извлечения, то есть механической обработки. Эфирные масла бергамота, полученные путем гидродистилляции, в отличие от масел холодного отжима, вряд ли содержат значительные количества бергаптена (31). Это связано с тем, что эти типы кумаринов нелегко испарить при относительно более низких температурах, используемых при гидродистилляции, поэтому они обычно присутствуют только в следовых количествах, если только масло не отжимается или не производится методом экстракции растворителем, приводящим к абсолютному значению.
Кумарины также потенциально связаны с антикоагулянтной активностью, но это еще не полностью исследовано. Хорошо известно, что двойной кумарин «дикумарол» (32) связан с возникновением внутреннего кровотечения, когда травоядные животные потребляют большое количество желтого донника (Melilotus officinalis Lam: Fabaceae). Если другие кумарины могут быть связаны с антикоагулянтной активностью, этот эффект можно использовать при лечении сердечно-сосудистых заболеваний [40]. Насколько нам известно, дикумарол (32) не обнаружен в эфирном масле. Однако в одном из таких исследований биологически активные кумарины изопсорален (33), ксантилетин (34) и остол (35) были обнаружены в следовых количествах в гидрозоле и эфирном масле после гидродистилляции листьев Geijera parviflora Lindl. (Rutaceae) [38]. Такие кумарины могут быть причастны к традиционному терапевтическому использованию этих растений, когда австралийские аборигены воскуривали эти растения.
Известно, что широкий выбор фурано- и пиранокумаринов оказывает биоактивное действие in vitro и должен лечь в основу дальнейших фармакологических исследований австралийских растений, используемых в медицине аборигенами. Фуранокумарин, гейпарварин и метоксикумарин дегидрогейерин (36) потенциально ответственны за различия во вкусовых качествах листьев G. parviflora у овец [92]. Химически подобный остол (35) уже был продемонстрирован в эфирных маслах G. parviflora [38], что делает вероятным, что дегидрогейерин (36) также может присутствовать в эфирных маслах. Однако, хотя гейпарварин не может присутствовать в гидродистиллированном эфирном масле, этот кумарин, несомненно, в большом количестве присутствует в экстракте, полученном с помощью гексана, или в конкрете.
Новые, а также известные кумарины были идентифицированы у P. trachyphylla (в этом исследовании - Eriostemon) [91]. Множество других известно из австралийских растений, но пока неизвестно, наблюдались ли какие-либо из них в гидродистиллированном эфирном масле, однако они, безусловно, в большом количестве присутствуют в ароматических препаратах в виде абсолюта.
Поскольку G. parviflora использовалась аборигенами Австралии в различных лечебных, церемониальных и развлекательных мероприятиях, необходимо исследовать участие кумаринов в этих видах деятельности. Например, десметильный конгенер гейпарварина уже продемонстрировал in vitro эффекты, согласующиеся с психоактивным седативным действием [93]. Из-за относительно большого размера этой молекулы неясно, может ли этот эффект быть связан с психоактивностью, достигаемой при традиционном курении [90].
Что касается использования кумаринов в медицине, как и в случае с другими соединениями, относительная и абсолютная стереохимия сильно влияет на субъективные и фармакологические эффекты [94], что, очевидно, делает синтез более дорогостоящим. Следствием этого является токсичный цис-анетол (37) диастереомер, который не образуется в природе, а скорее является следствием синтетического производства лекарственного соединения транс-анетола (37), которое получают в стереочистых формах из анисового масла (Pimpinella anisum L .: Apiaceae) или масла семян фенхеля (Foeniculum vulgare Mill: Apiaceae) [90]. Влияние стереохимии и хиральности на фармакокинетику и фармакодинамику лекарств теперь полностью оценено [95], и исследователи начинают серьезно исследовать эффекты в натуральных продуктах и синтетической медицине.
Оригинал статьи:
A Contemporary Introduction to Essential Oils: Chemistry, Bioactivity and Prospects for Australian Agriculture
https://www.mdpi.com/2077-0472/5/1/48/htm
Sadgrove, Nicholas, and Graham Jones. 2015. “A Contemporary Introduction to Essential Oils: Chemistry, Bioactivity and Prospects for Australian Agriculture.” Agriculture 5 (1):48–102. https://doi.org/10.3390/agriculture5010048.
