Современные представления о эфирных маслах: химия, биологическая активность и перспективы для сельского хозяйства Австралии 4
Современные представления о эфирных маслах: химия, биологическая активность и перспективы для сельского хозяйства Австралии. Обзорная статья, часть 4.
Авторы: Nicholas Sadgrove и Graham Jones
Agriculture 2015, 5(1), 48-102; https://doi.org/10.3390/agriculture5010048
4. Выводы: предлагаемые области для дальнейших исследований.
...
Интересным и неожиданным следствием нынешнего обзора является «возрождение» хемотаксономии, которая использовалась в Австралии ботаниками в 70-х и 80-х годах, прежде чем молекулярный дактилоскопический анализ стал возможен и быстро стал популярным. В связи с этим возникает вопрос: «Как вы определяете вид»? Хемотаксономия сталкивается с проблемой разделения на «новые виды» и «новый хемотип одного вида». Чтобы еще больше усложнить вопрос, в некоторых случаях было продемонстрировано, что может быть установлена корреляция между генетикой (кариотипом) и хемотипом, например, с E. longifolia [68]. Это резко контрастирует с классическим представлением о том, что хемотипы являются результатом различий в почве и климате. Согласно прежней «генетической» точке зрения, саженцы одного хемотипа можно было пересаживать в разные типы почвы и в разные климатические условия без каких-либо серьезных изменений химического состава его эфирного масла. В последнем, более классическом взгляде, несомненно, будет разница.
Мнение о том, что хемотип является производным от типа почвы, заимствовано из Европы и Великобритании, где селекция сортов на протяжении тысячелетий вызвала своего рода генетическое единообразие у многих видов, используемых в культивации. Однако, поскольку этот выбор сорта не применялся австралийскими аборигенами, более вероятно, что уникальные типы почв и различные климатические условия благоприятствуют определенным биотипам - это означает, что само растение отличается и лучше подходит для этой среды.
В течение долгого времени географически изолированные хемотипы могут расходиться в новые виды, но, опять же, проблема заключается в том, чтобы точно решить, какое количество дивергенции оправдывает определение границ нового вида. Из-за присущей двусмысленности ответа на такой вопрос, лучшее решение на данный момент состоит в том, что стойкие морфологические различия должны стоять отдельно при определении нового вида, но хемотаксономия и филогенетика могут использоваться для демонстрации того, что такая морфологическая изменчивость не является просто следствием естественной изменчивости внутри одного вида.
Приложение к статье.
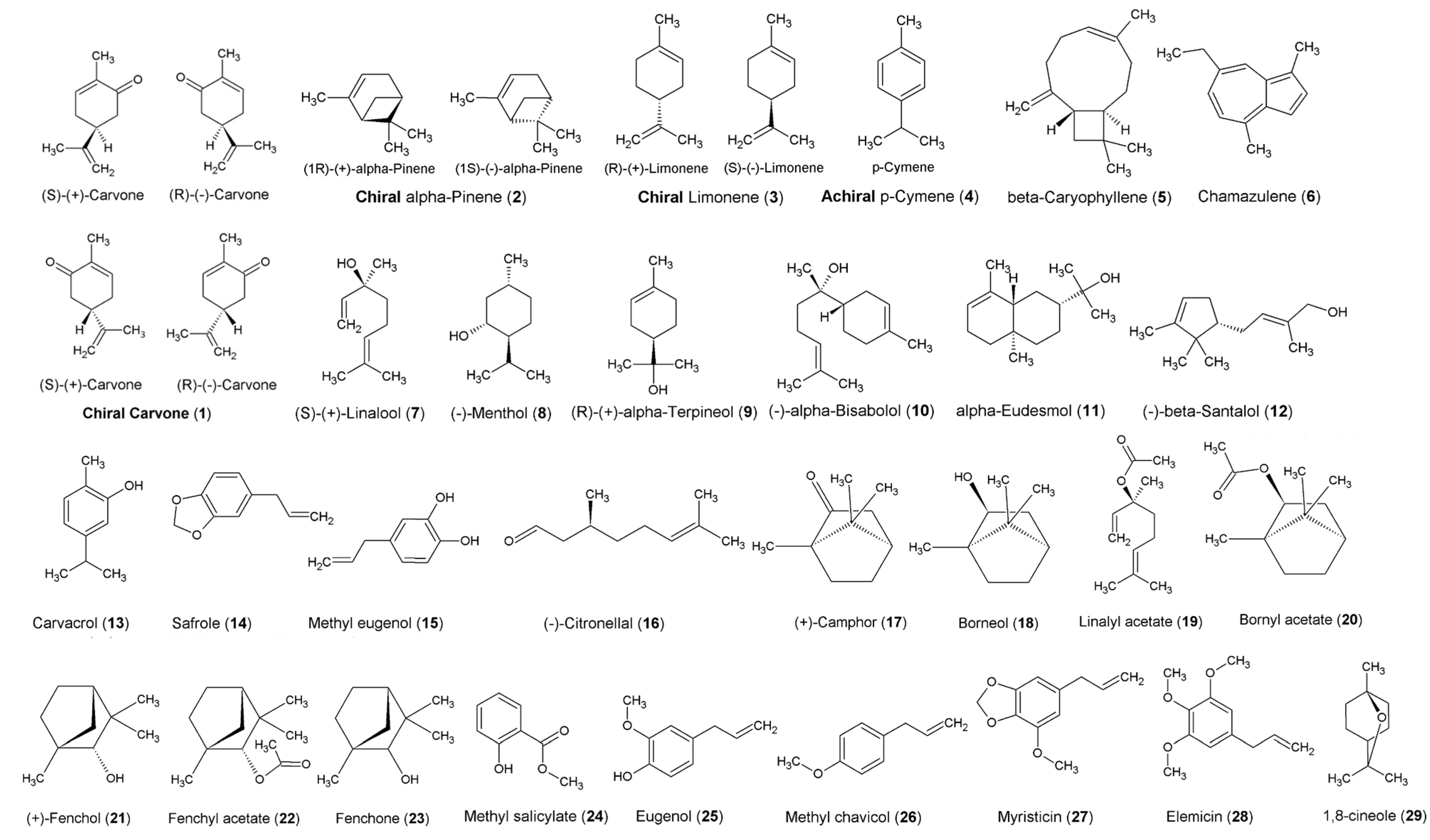
Рисунок А1. Химическая структура компонентов эфирных масел, упомянутых в этом исследовании.
Введение в линейные структуры и хиральные концепции, используемые в органической химии
...
При химической идентификации трехмерное пространственное строение или стереохимия соединительных частей молекулы, а также положение двойной связи могут значительно влиять на химическое поведение и фармакологическую активность соединения. Обычно небольшие различия в пространственной конфигурации (не путать с конформацией) приводят к обнаруживаемым различиям в химическом анализе, таком как газовая хроматография (ГХ) или спектроскопия ядерного магнитного резонанса (ЯМР). Однако часто одно изменение пространственной конфигурации одной молекулы может привести к образованию другого соединения, которое является ее точным зеркальным отображением, называемого энантиомером. Когда молекула хиральна, это означает, что у нее есть энантиомер или зеркальное отражение самой себя. На рисунке 2 изображены два энантиомера карвона (1), который представляет собой хиральную молекулу. Хотя кажется, что на рисунке 2 четыре молекулы, на самом деле их всего две, причем каждый энантиомер (S + или R-) изображен как спереди, так и сзади.
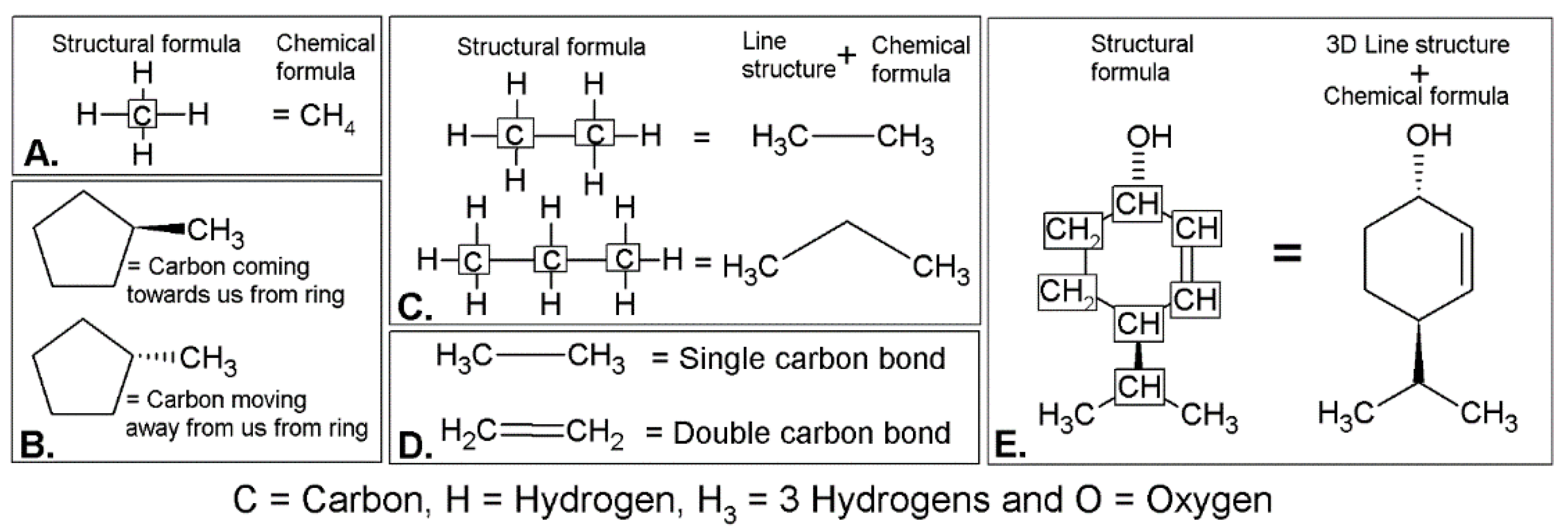
Рисунок A2. Уроки A – E, демонстрирующие, как интерпретировать представление линейной структуры органической молекулы. (А) разница между структурной формулой и химической формулой; (B) Как передается пространственное распределение (стереохимия); (C) Разница между структурной формулой и линейными структурами, которые используют химическую формулу для метильных групп; (D) одинарные и двойные связи; (E) Структурная формула по сравнению с ее эквивалентной линейной структурной схемой с использованием трехмерного эффекта и химической формулы для метильных групп.
Вкратце, хиральный центр идентифицируется центральным атомом углерода, который связан с четырьмя различными группами (рис. 3А). Часто одна из этих связей связана с атомом водорода, но обычно не показана в линейной структуре. Хотя ρ-цимен (4) не имеет хирального центра, одно из двух гипотетических соединений, изображенных на рисунке 3 (B), имеет. Соединение слева имеет хиральный центр, но его нет, потому что две связи идентичны, а соединение симметрично. Это означает, что, хотя существует трехмерное пространственное строение, оно не создает новую молекулу, потому что оно накладывается на свое зеркальное отображение. Однако соединение справа имеет хиральный центр на том же атоме углерода, но наличие двойной связи в молекуле означает, что оно не имеет плоскости симметрии. Следовательно, соединение слева является хиральным, а другое - нет (ахиральным).
В том маловероятном случае, если у молекулы есть и хиральный центр, и плоскость симметрии, это называется «мезо» соединением, но это может произойти только в том случае, если в одной молекуле находятся два хиральных центра, каждый из которых компенсирует другой, вращая плоскость. поляризованный свет в равных и противоположных направлениях. Однако, в отличие от ахирального соединения, которое вращается на 180° вокруг своей плоскости симметрии, параллельно своему зеркальному отображению, чтобы реализовать свою синонимию, мезосоединения вращаются вокруг своей плоскости симметрии на 180° перпендикулярно своему зеркальному отображению. Обычно мезосоединения не обсуждаются в химии эфирных масел. В мезосоединении два хиральных центра должны иметь противоположные конфигурации (то есть как S, так и R) и плоскость симметрии. Конфигурации S и R показаны на рисунке 3.
Продолжение, часть 5, список литературы.
Оригинал статьи:
A Contemporary Introduction to Essential Oils: Chemistry, Bioactivity and Prospects for Australian Agriculture
https://www.mdpi.com/2077-0472/5/1/48/htm
Sadgrove, Nicholas, and Graham Jones. 2015. “A Contemporary Introduction to Essential Oils: Chemistry, Bioactivity and Prospects for Australian Agriculture.” Agriculture 5 (1):48–102. https://doi.org/10.3390/agriculture5010048.
