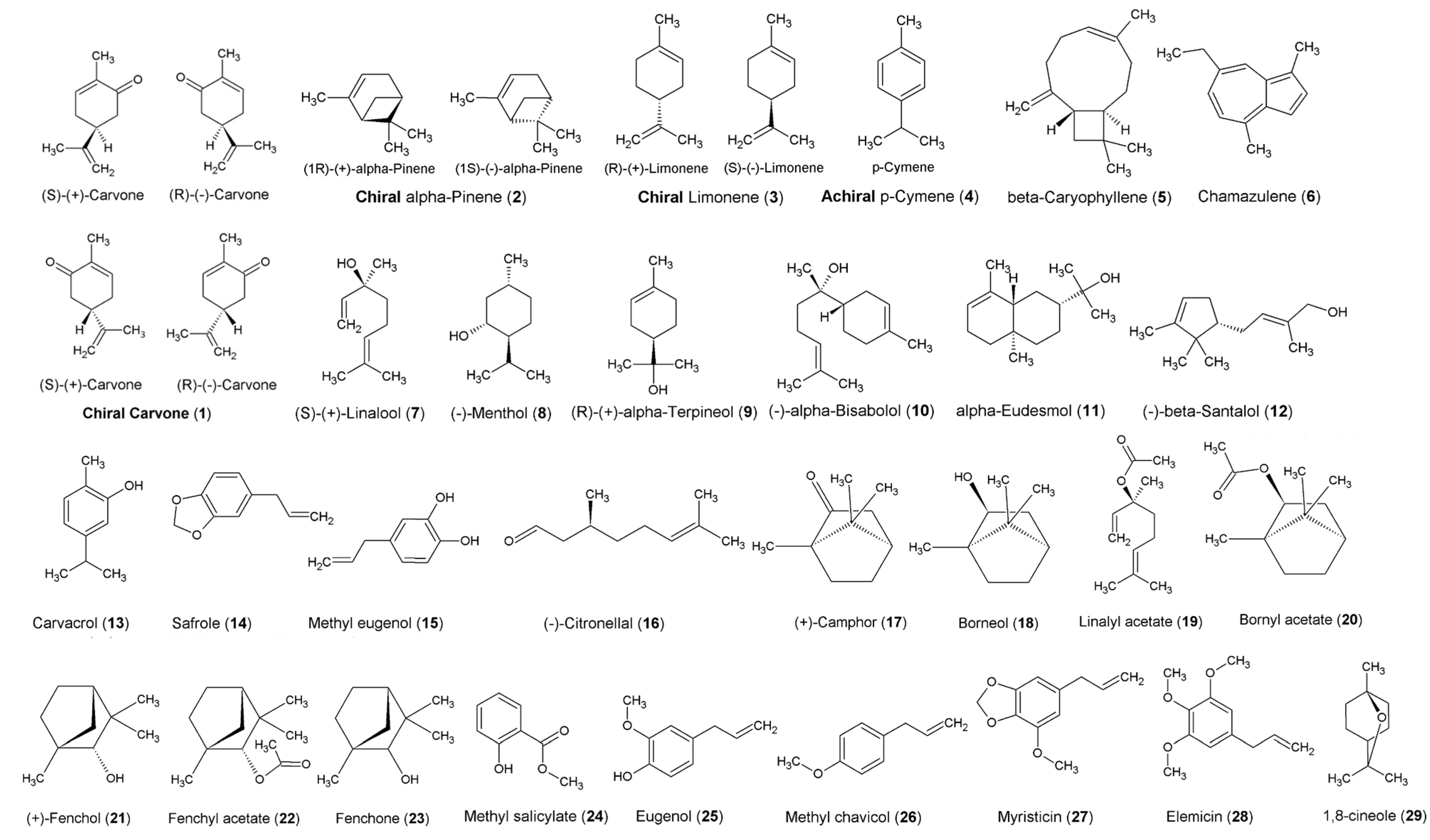
Современные представления о эфирных маслах: химия, биологическая активность и перспективы для сельского хозяйства Австралии. Обзорная статья, часть 1.
Авторы: Nicholas Sadgrove и Graham Jones
Agriculture 2015, 5(1), 48-102; https://doi.org/10.3390/agriculture5010048

Предисловие.
Этот обзор представляет собой всестороннее введение в соответствующие аспекты методологии экстракции, химии, анализа и фармакологии эфирных масел, а также дает представление об общих концепциях органической химии для читателей, не связанных с химией. Кроме того, в нем описываются исторические аспекты исследований эфирных масел, а также исследуются спорные вопросы терминологии. Затем следует изучение растений, производящих эфирные масла, в контексте Австралии с особым вниманием к обычаям аборигенов, историческим успехам и современным коммерческим перспективам. Из-за суровой засушливой среды австралийской суши, особенно из-за циклических климатических изменений, сопровождающих повторяющиеся циклы оледенения / послеледникового периода, в засушливых регионах появился богатый ассортимент уникальных эндемичных растений, дающих эфирное масло. Хотя некоторые из этих ароматических растений (особенно виды миртовых) дали начало коммерчески ценным отраслям, многое еще предстоит открыть. Учитывая потенциал рынка, вполне вероятно, что недавние открытия в нашей лаборатории и в других местах приведут к разработке новых продуктов. Этот обзор завершается акцентом на использование хемотаксономии при отборе коммерчески жизнеспособных хемотипов сортов с австралийского континента. Наконец, опираясь в основном на наши собственные результаты, мы предлагаем список австралийских эндемичных видов с новым коммерческим потенциалом.
1. Введение.
1.1. Терминология эфирных масел и методы производства.
Эфирные масла представляют собой смесь летучих липофильных (т.е. растворимых в жире) компонентов, чаще всего получаемых из листьев, веток, древесной пульпы или коры высших растений, но также широко встречающихся у мохообразных, таких как печеночники [1 ]. Хотя эфирные масла слабо растворимы в воде, растворимость в воде отдельных компонентов эфирных масел зависит от полярности молекул. Обычно ожидается, что компоненты с более полярными функциональными группами будут более растворимы в воде по сравнению с другими компонентами.
Эфирные масла чаще всего производят с помощью гидродистилляции; однако до этого отдельные компоненты всего эфирного масла присутствовали в исходной ткани либо в той же молекулярной форме, либо в виде термолабильного предшественника. Процесс гидродистилляции включает нагревание в присутствии воды до температур выше точки кипения с образованием смешанных газов, которые расширяются и попадают в конденсатор. Разновидностью этого является паровая дистилляция, при которой исходная ткань (листья, стебель или кора) помещается на пути пара, а не в самой кипящей воде, как при гидродистилляции.
Во время гидродистилляции образуются смешанные газы (пар и масляные испарения), испаряются в конденсатор, где они охлаждаются до температуры ниже 30°C и конденсируются на две разделенные (несмешивающиеся) жидкие фазы; одна фаза представляет собой гидрозоль, а другая - эфирное масло. Две конденсированные жидкости под действием силы тяжести поступают в делительную воронку, где они разделяются. Проблемы возникают, когда гидродистилляция выполняется при более высоких температурах, потому что температура гидрозоля недостаточно снижается перед поступлением в делительную воронку. Следствием этого является фракционирование эфирного масла с большим количеством компонентов с более высокими температурами кипения. Кроме того, может быть вообще невозможность конденсировать какое-либо эфирное масло; или при конденсации эфирные масла могут подвергаться повторному испарению, если температура гидрозоля слишком высока. Таким образом, обычно приоритетной задачей является регулирование температуры кипения для оптимизации гидродистилляции для максимального увеличения выхода эфирного масла.
Большинство авторитетов утверждают, что если для сбора жидкостей, содержащих летучие соединения, используется другой процесс, кроме гидро- или паровой дистилляции, такой как экстракция растворителем или механическое прессование, продукт не следует рассматривать как эфирное масло и вместо этого может называться «абсолютным маслом». При приготовлении «абсолюта» гексановый экстракт сначала извлекается из сырья и выпаривается для получения «конкрета». Конкрет растворяют в этаноле и охлаждают до -20°C. При этой более низкой температуре воски, стерины и другие липиды затвердевают и удаляются, что приводит к концентрации летучих соединений в продукте; абсолют.
Для описания ароматических препаратов можно использовать множество других названий, таких как «тинктура/настойка», «олеорезин» и так далее. Термин «эфирное масло» обычно используется, если делается ссылка на летучую фракцию любого из этих экстрактов, но это выражение также включает эфирные масла. При этом некоторые авторитетные специалисты по-прежнему называют масло из кожуры цитрусовых, полученное механическим способом, эфирным маслом, и это подтверждается Международной организацией по стандартизации [2, 3].
Точное определение термина "эфирное масло" может быть предметом споров среди заинтересованных лиц, включая ученых, ароматерапевтов или непрофессионалов. Хотя в целом достигнут консенсус, методы экстракции/извлечения все еще развиваются, и это может внести дополнительную путаницу в терминологию. Эфирные масла теперь можно экстрагировать с помощью современных методов гидродистилляции с использованием микроволн [4,5] или перегонки с помощью микроволн, которые не требуют дополнительной воды, кроме цитозольных и сосудистых жидкостей, уже присутствующих в исходной ткани [6]. Эти методы приводят к различиям, как качественным, так и количественным, в составе и выходе последующего эфирного масла [4,6]. Строго говоря, последний метод, не требующий дополнительной воды, не гидродистилляция, а просто дистилляция.
В связи с этим Международная организация по стандартизации (ISO) определяет эфирное масло как:
«Продукт, полученный из природного сырья путем перегонки с водой и паром, или из кожуры цитрусовых путем механической обработки, или путем сухой перегонки». [2,3]
Что касается классификации масел, выделенных из кожуры цитрусовых, таких как масло апельсина или бергамота, их обычно называют эфирными маслами [7,8]. Однако, используя эту терминологию, их можно спутать с эфирными маслами, полученными с помощью гидродистилляции. В первом случае при экстракции масла исходная ткань не подвергается гидродистилляции, а последующее масло содержит растворенные липиды (воски и стеролы) и другие более крупные нелетучие соединения, такие как кумарин бергаптен (31) (см. Рисунок A1) в случае масла бергамота (Citrus bergamia Risso.) [8,9].
Дальнейшие последствия определения эфирных масел появляются при рассмотрении традиционных медицинских применений ароматических растений. Это особенно актуально, когда растительный материал нагревается до образования едкого парообразного дыма, а затем конденсируется либо на коже [10], либо в легких при вдыхании [11]. В этом контексте лечебные эффекты могут иногда быть вызваны молекулярным взаимодействием между множеством соединений, которое может иметь как липофильный, так и гидрофильный характер. Такие потенциально синергетические взаимодействия не будут происходить при использовании только чистого эфирного масла, полученного при гидродистилляции [10]. Однако чаще всего задействовано одно активное соединение, которое производит большую часть лечебного эффекта [12], который может иметь липофильный или гидрофильный характер.
В связи с этим, немного более крупные неповрежденные или модифицированные соединения испаряются в больших количествах, когда задействованы более высокие температуры, например, в практике окуривания дымом у австралийских аборигенов [12] или, действительно, при дистилляции с помощью микроволн [4,6]. Эти немного более крупные соединения могут быть найдены в имитированных экстрактах курения или растворены либо в эфирном масле, либо в гидрозоле, когда используется микроволновая дистилляция.
Кто-то может предложить, чтобы летучие масла, полученные с использованием технологии микроволновой дистилляции или гидродистилляции, правильно называть эфирными маслами из-за химического изменения термолабильных компонентов, которые становятся частью эфирного масла как с натуральными ингредиентами, так и с этими производными «артефактами». Очевидно, что это предмет разногласий, и отрасли эфирных масел, возможно, потребуется приступить к разработке новой системы передачи информации, связанной с методом дистилляции, используемым для производства продуктов на основе эфирных масел, чтобы повысить осведомленность потребителей о потенциальных качественных различиях. Подобный подход может также потребовать включения отжатых масел из кожуры цитрусовых, чтобы избежать путаницы с гидродистиллированными маслами, также получаемыми из кожуры цитрусовых. Кроме того, в случае нагревания растительного материала для получения лечебных газов в этномедицинских контекстах это может быть распознано как смесь эфирных масел и других более крупных соединений, таких как дитерпены, вместе с более гидрофильными компонентами, которые обычно не обнаруживаются в значительных количествах в эфирном масле как таковом.
Чтобы избежать дальнейшей путаницы, исследователи и ученые часто используют слово «гидродистиллированное» или недавнее «дистиллированное» вместо «экстрагированного», если они имеют в виду эфирное масло.
Споры относительно номенклатуры эфирных масел также влияют на историю использования эфирных масел, поскольку летучие масла, использовавшиеся ранее, могут не подпадать под современное определение «эфирного масла», поскольку они не подвергались гидродистилляции в общепринятом смысле. Например, нет никаких доказательств того, что современная технология гидродистилляции была доступна в библейские времена или в Древнем Египте, а это означает, что медицинские применения, описанные в этих более ранних ссылках, скорее всего, использовали экстрагированные или абсолютные масла со смесью летучих и фиксированных компонентов и, следовательно, не использовались эфирные масла сами по себе [13], как принято считать [7,14].
Самое раннее достоверное описание эфирного масла, полученного методом, напоминающим обычную гидродистилляцию, было составлено Арнальдом де Виллановой (Arnald de Villanova) где-то в конце 12 или начале 13 века (1235–1311 гг. Н.э.). До этого детали примитивной формы дистилляции, используемой для производства скипидара и камфары (17), были описаны древними римлянами и греками в первом веке [13]. Однако, поскольку никакое другое эфирное масло не производилось таким образом, неясно, можно ли это рассматривать как доказательство производства эфирного масла в то время. Хотя есть явные доказательства того, что примитивная форма дистилляционной технологии использовалась с 400 г. до н.э. (терракотовый дистилляционный аппарат, датируемый примерно 400 г. до н.э., сейчас хранящийся в Музее Таксила, Пакистан) до девятого века, этот метод в основном использовался для производства дистиллированной воды, в которой фракционированные эфирные масла, такие как камфора (17), часто производились в качестве побочного продукта [13]. Используя такую примитивную гидродистилляцию, можно без труда получить дистиллированную воду или «гидрозоли», но ценные эфирные масла невозможно уловить без современных методов, позволяющих охлаждать пар до требуемых более низких температур. Таким образом, могут быть сохранены только компоненты эфирного масла с более высокими температурами кипения, такие как камфора (17).
Технология дистилляции была усовершенствована в девятом веке более ранними арабскими учеными [15,16], но опять же неясно, использовали ли они эту технологию для преднамеренного производства эфирных масел или основное внимание уделялось цветочной воде. Таким образом, историки в настоящее время согласны с тем, что технология эфирных масел, которая была принята для терапевтического использования в Европе в средние века, была основана на работе Виллановы 13 века, которая предоставила самую раннюю запись, которая может быть надежно подтверждена [13].
Компоненты эфирного масла обычно имеют размер не более 300 дальтон [17], за исключением необычных случаев, связанных с более крупными дитерпеноидами, такими как ацетат инсенсола из Boswellia spp. [18,19,20] и они требуют более длительных периодов гидродистилляции (возможно, более высоких температур) с когобацией. Это положение может измениться с появлением новой технологии дистилляции, которая производит немного более тяжелые молекулы (примерно 350 Дальтон), таких как вышеупомянутый метод дистилляции с использованием микроволн.
Что касается получения цветочных вод или гидрозолей, гидрофобный характер эфирного масла вызывает фазовое разделение масла и воды, но следовые количества эфирных масел растворяются, как упоминалось ранее. Обычно из-за относительно низкой точки насыщения гидрозоль растворяет только небольшие количества эфирных масел, но иногда летучие компоненты могут растворяться в гидрозолях при относительно высоких концентрациях [12]. В таких случаях эти компоненты имеют большую полярность, чем другие компоненты эфирных масел, что делает их более растворимыми в воде. Минимизация количества дистилляционной воды и повторное использование гидрозоля может значительно повысить выход масла, полученного при гидродистилляции. Когобация - это один из методов, используемых для уменьшения потерь эфирного масла за счет растворимости в гидрозоле, когда гидрозоль вручную возвращается в куб на протяжении всего периода гидродистилляции.
Другой метод, используемый для уменьшения потерь эфирного масла на растворение в гидрозоле, использует устройство Клевенджера (рис. 1), которое возвращает гидрозоль в дистиллятор в режиме реального времени во время перегонки. Это также уменьшает общий объем воды, первоначально необходимый для дистилляции. К сожалению, одна из проблем при использовании аппарата Клевенджера заключается в поддержании более низкой температуры гидрозоля, поскольку более высокие температуры могут привести к снижению выхода масла или к образованию эмульсии масла в гидрозоле. Недостатком аппарата Клевенджера является то, что эфирные масла должны плавать (быть менее плотными, чем вода), иначе они уйдут обратно в куб с гидрозолем.
Как показано на рисунке 1, конденсатор (D) расположен непосредственно над устройством типа Клевенджера (C). Здесь мы наклонили конденсатор так, чтобы конденсаты текли по сторонам стекла и встречались с жидкостью с пониженной скоростью. В традиционной пространственной конфигурации типа Клевенджера конденсатор расположен вертикально по отношению к поверхности жидкости, но, по нашему опыту, падение жидкости из конденсатора нарушает фазовое разделение эфирного масла и гидрозоля. Кроме того, размещение конденсатора таким образом, чтобы конденсированные жидкости возвращались через проход пара, является причиной трудности снижения температуры гидрозоля. Для борьбы с этим мы отрегулировали нагревательный кожух (B) на более низкую температуру с помощью регулятора мощности (A). Однако лучшей мерой было бы изменить устройство Клевенджера так, чтобы включить водяную рубашку вокруг фаз эфирного масла и гидрозоля для поддержания более низкой температуры и, следовательно, предотвращения повторного испарения.
Фаза эфирного масла обычно плавает над гидрозолем, но в редких случаях, когда эфирное масло плотнее воды, оно оседает ниже гидрозоля [21]. Например, некоторые фенилпропаноиды, такие как сафрол (14) и метилэвгенол (15), плотнее воды и оседают ниже гидрозоля, но только если они занимают достаточно высокое относительное содержание во всем эфирном масле. Примером этого является эфирное масло, полученное из одного из хемотипов Eremophila longifolia (Scrophulariaceae) в Западной Австралии [22], которое представляет собой смесь сафрола (14) и метилэвгенола (15), составляющую примерно 97% от состава эфирного масла. В этом конкретном случае гидродистилляция этого вида с использованием аппарата типа Клевенджера не сможет захватить эфирное масло, потому что оно вернется в куб с гидрозолем.

Рисунок 1. Гидродистилляция с использованием аппарата Клевенджера. (A) Регулятор мощности; (B) Нагревательный кожух с круглодонной колбой, содержащей воду и ароматическое сырье; (C) Аппарат типа Клевенджера, который возвращает гидрозоль в дистиллятор и поддерживает фазу эфирного масла, но только для эфирных масел, которые менее плотны, чем вода, и поэтому плавают; (D) Конденсатор.
Эфирные масла биологически рассматриваются как метаболиты, имеющие второстепенное значение для организма, потому что, в отличие от первичных метаболитов, они не универсальны для всего растительного мира и не составляют каких-либо основных строительных блоков жизни [17]. Хотя такие вторичные метаболиты обычно считаются побочными продуктами метаболизма, широко признано, что они обеспечивают эволюционное преимущество для растения (или мха печеночника), которое может включать защиту от таких организмов как грибы, насекомые или травоядные. В качестве альтернативы эфирные масла могут играть менее очевидную экологическую роль, например, в отношении огнестойкости, привлечения опылителей и / или травоядных животных для распространения семян, устойчивости к засухе или биосемиоза между растениями (феромоны).
Хотя эфирные масла могут вносить значительный вклад в эволюционное выживание соответствующего организма, термин «эфирное масло» не связан с этой функцией. Распространенное заблуждение состоит в том, что эфирные масла называют «эфирными» маслами (душа растения), чтобы подчеркнуть их важность для биологического выживания организма. Однако термин «эфирное масло» на самом деле происходит от слова «quintessence», английского перевода Quinta essentia. Этот термин означает пятый элемент в более раннем алхимическом созвездии, использовавшемся для эфирных масел в начале 16 века швейцарским пионером медицины Бомбастом Парацельсом фон Гогенхаймом [13]. В то время фон Гогенхайм считал, что эфирное масло является наиболее чистой и концентрированной формой лекарственного вещества любого растения, полученной путем гидродистилляции растительной ткани.
Использование термина «квинтэссенция» фон Гогенхаймом является отражением парадигмы Аристотеля, которая описывала материю как состоящую из пяти элементов: земли, огня, воды, воздуха и духа. Квинтэссенция (буквально пятая сущность) рассматривалась как последняя из них; дух или жизненная сила растения, которую можно удалить и удержать в процессе дистилляции. Использование современного термина «духи» для описания различных жидкостей, в частности, произведенных путем дистилляции, снова является отражением этой древней концепции [17].
Эфирному маслу дано множество других названий. К ним относятся эссенция, ароматное масло, эфирное масло или ароматическое масло [21]. Последний термин «ароматический» - это еще один термин, который вызывает много недоразумений и споров. Хотя термин «ароматический» в современном использовании описывает качество испускания аромата, который либо приятен, либо отвратителен для носа, ароматическое соединение или часть, говоря языком химии, имеет химическое строение, которое приводит к делокализации электронов. обеспечение большей молекулярной стабильности. Таким образом, эфирные масла могут быть смесью ароматических и алифатических (неароматических) соединений, все из которых способствуют ощущаемому аромату. Это очевидно для профессиональных химиков, но приводит к путанице с другими ненаучными пользователями эфирных масел.
Говоря строго химически, ароматические соединения, также часто называемые аренами, содержат ароматическую группу. Ароматическая группа плоская, циклическая с перекрывающимися p-электронными орбиталями и нечетным числом электронных пар в пределах образования π-связи ((4n + 2) / 2). Хотя бензольный фрагмент является наиболее часто цитируемым примером [21]; другие ароматические группы включают гетероциклы пиррол, пираны, фураны и тиофены.
Термин ароматическая (или арен) впервые вошел на язык химии, когда Август В. Хофманн (1855) использовал его в отношении ряда летучих одно- и «двухосновных [sic] кислот», включая условно названную инсолиновую кислоту. Поскольку все соединения в ряду Хофмана содержат бензольный фрагмент, термин «ароматический» стал ассоциироваться с ареновыми соединениями [23]. Поскольку все соединения в ароматическом ряду Хофмана содержат бензольную составляющую и имеют запах, термин ароматический стал ассоциироваться с эфирными маслами и другими молекулами, вызывающими запах. Когда развитие химии в конечном итоге продемонстрировало, что соединения, вызывающие запах, в основном представляют собой терпены и другие небензоидные химические группы, термин «ароматические» для описания этих соответствующих соединений сохранился. Таким образом, хотя термин «ароматические растения» в настоящее время широко используется для описания разновидностей, дающих эфирные масла, большинство соединений эфирных масел являются алифатическими в строгом химическом смысле.
1.2. Химия, хиральность и стереохимия эфирных масел
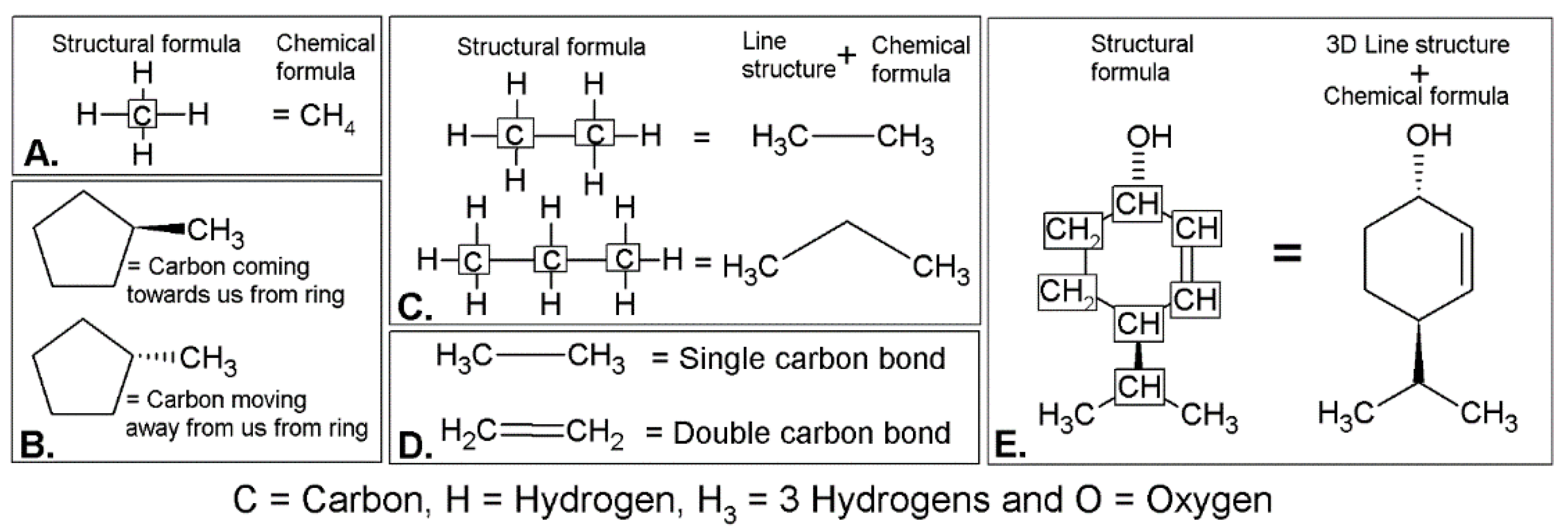
Конференции по эфирным маслам привлекают участников из самых разных профессий с разнообразным опытом. Некоторые из участников будут опытными химиками, в то время как другие вообще не знакомы с химией. Обычно ожидается, что наши читатели будут иметь хотя бы базовый уровень химии, но для читателей, не знакомых ранее, мы включили изображение и пояснения в Приложение, чтобы помочь в понимании молекулярных диаграмм, на Рисунке A2; уроки A – E. Кроме того, в Приложение включена информация, связанная с пониманием хиральности и стереохимии.
В химии эфирных масел большое значение имеют хиральность и стереохимия компонентов. Это связано с тем, что пространственная ориентация соединительных частей молекулы может значительно влиять на химическое поведение и фармакологическую активность соединения. В связи с этим молекулы с одинаковой молекулярной формулой и одинаковыми связями между атомами, но с различным пространственным расположением этих атомов, называются стереоизомерами. Два основных типа стереоизомеров, которые имеют отношение к обсуждению эфирных масел, - это диастереомеры и энантиомеры.
Обычно пару стереоизомеров называют диастереомерами, которые выделяют как отдельные объекты в обычном химическом анализе, таком как газовая хроматография (ГХ) или спектроскопия ядерного магнитного резонанса (ЯМР). Однако некоторые стереоизомеры являются точными зеркальными отображениями друг друга, которые нельзя накладывать друг на друга, как, например, левая и правая стороны (рис. 2). Каждый из них называется энантиомером хиральной молекулы. Примером хирального соединения является карвон (1) (рис. 2). Поскольку карвон (1) является хиральной молекулой, различия между энантиомерами нельзя наблюдать с помощью рутинной ГХ или ЯМР [24].
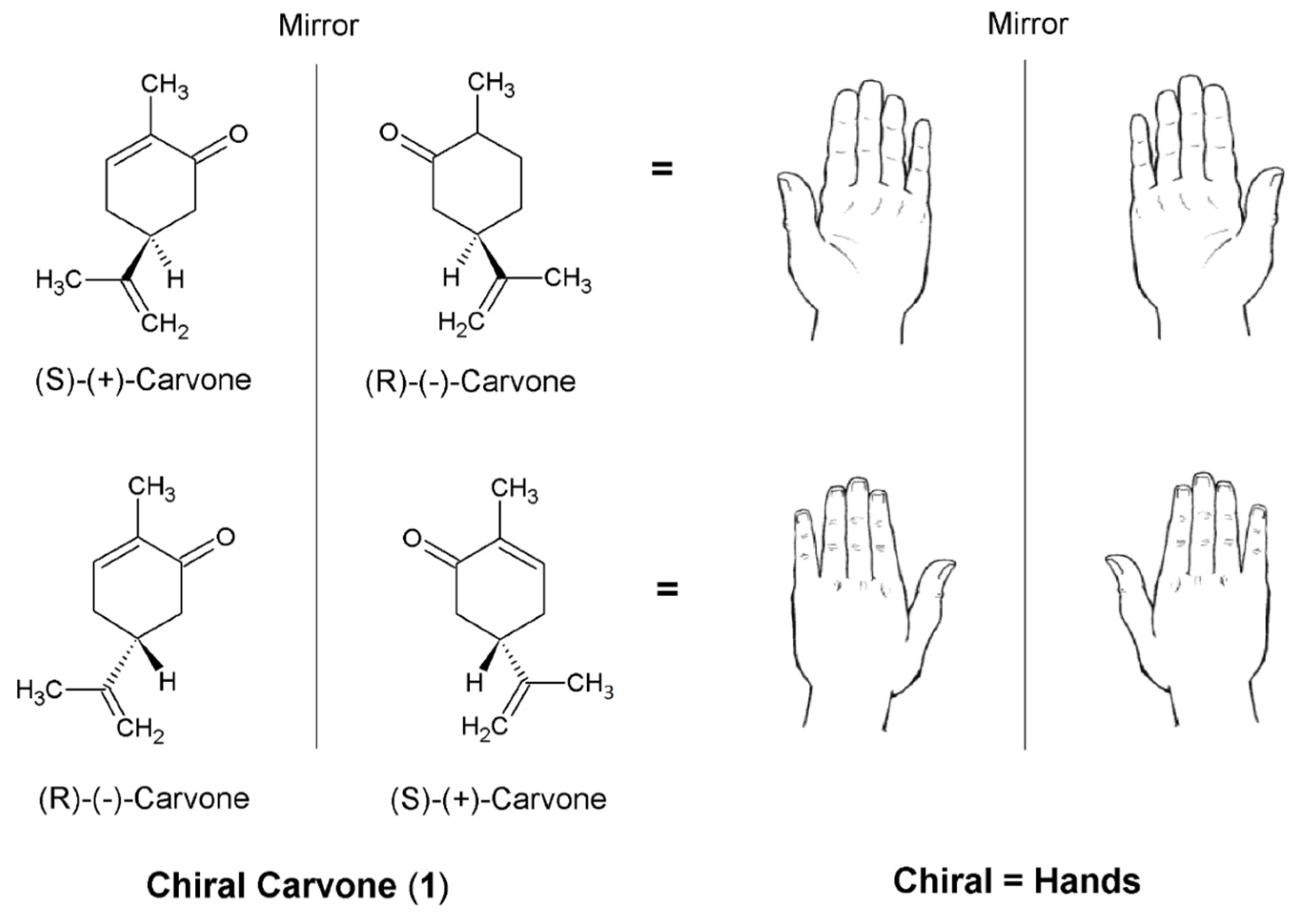
Рисунок 2. Два энантиомера карвона (1).
Термин «хиральный» впервые вошел в химический язык после того, как он был введен лордом Кельвином в 1893 году [25]. Оно происходит от греческого слова «рука», самого известного хирального объекта в природе. До того, как появилась технология для выяснения абсолютной стереохимии хиральных соединений, они были идентифицированы на основе способности вращать плоско поляризованный свет. Соединения, которые способны вращать плоскополяризованный свет, известны как «оптически активные», и им присваивается измерение «удельного вращения», которое обычно является уникальным для каждого хирального соединения. Однако каждый энантиомер в хиральном соединении будет вращаться одинаково в противоположных направлениях, один вправо, а другой - влево. Таким образом, один будет иметь отрицательное удельное вращение, которое находится слева, а другой будет иметь такое же положительное значение, что справа. Используя терминологию латинского языка, вращение вправо является правовращающим (dextro - производным от dexter для «правого»), а вращение влево - левовращающим (laevo- производным от laevus для левого). Таким образом, на более старом языке химии префикс для обозначения энантиомеров был либо d-, либо l-. Примеры того, где сохранился этот язык, включают d-альфа-пинен (2) и d-лимонен (3) (рисунок A2), которые иногда обозначаются как d - (+) - альфа-пинен и d - (+) - лимонен. , соответственно. Однако в последнее время использование d- и l- было прекращено и заменено символами положительного (+) и отрицательного (-) [21,24].
Примером ахиральной (не хиральной) молекулы является ρ-цимен (4). Эта молекула является ахиральной, потому что она накладывается на свое зеркальное изображение, но у нее нет хирального центра (имейте в виду, что ароматическое кольцо имеет делокализованные электроны, поэтому размещение двойных связей произвольно). Более ясная картина того, как выглядит хиральный центр, поясняется на рисунке 3.
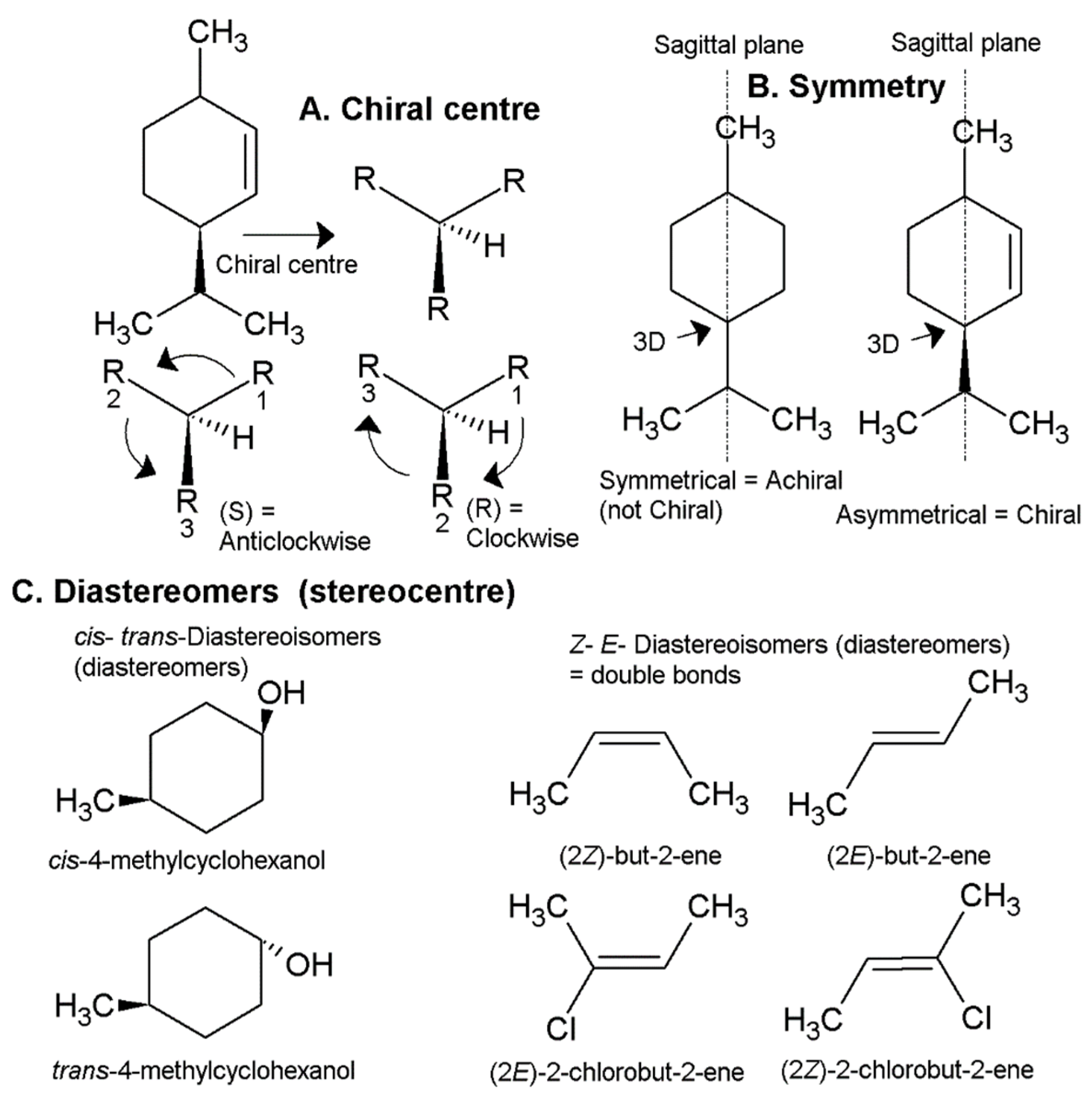
Рисунок 3. Стереохимия молекулы, где вращение приоритетных связей вокруг хирального центра определяется как S или R (A), где симметрия может влиять на то, является ли что-то хиральным или ахиральным (B), и где два хиральных центра (или стереоцентр) для двойных связей может привести либо к цис-, либо к транс-изомерии (C), что может быть более точно обозначено Z- и E-, если изомерия происходит по двойной связи.
Удельное вращение хирального соединения измеряется с помощью поляриметра. Хотя эта технология довольно старая, ее использование в химии продолжается и по сей день. Однако, поскольку химики теперь осведомлены об абсолютной стереохимии каждого энантиомера (точная трехмерная конфигурация связей), правила описания энантиомера дополняются дескрипторами S или R (рис. 3A). Это помогает химикам передать трехмерное пространственное расположение атомов или групп вокруг связи, не прибегая к рисованию диаграммы. Такие дескрипторы обычно используются только в общем названии компонента эфирного масла, где присутствует только один хиральный центр, в противном случае каждому хиральному центру следует присвоить конфигурацию S или R, то есть (1R, 5R) - (+) - альфа- Пинен (2). Однако там, где конфигурации идентичны, принято использовать дескриптор только один раз, то есть (R) - (+) - альфа-пинен (2) [24].
Распространенное заблуждение - полагать, что S или R указывают направление вращения плоско поляризованного света, но это неверно. Хиральный центр, который находится в S-конфигурации, может быть либо положительным (+), либо отрицательным (-) энантиомером, но всегда будет противоположным R-конфигурации. Таким образом, если S = (+), то R = (-) и наоборот [24].
Хиральный центр определяется как S или R путем вращения приоритетных групп вокруг основного углерода в связи (рис. 3A); это чисто конституционная концепция. Приоритетные группы определяются правилами приоритета Кана-Ингольда-Прелога (CIP), которые определяют приоритеты групп на основе более высокого атомного номера (более высокие числа = более высокий приоритет). Правила CIP подробно объясняются в любом современном учебнике органической химии [24].
В хиральном центре вращение приоритетных связей против часовой стрелки (влево от 12 часов) называется S, что происходит от латинского слова sinister (рис. 3A), означающего «неправильно» или «влево». В направлении по часовой стрелке он называется R от rectus, что означает «прямой» или «правильный», но в данном контексте он может означать «вправо» или «правильно». Поскольку в древних обществах влияние левой стороны считалось злом, латинское слово «зловещий», означающее «левый», сохранилось и сегодня в английском языке и означает зло или угрозу, больше не связанное с левыми. Однако очевидно, что современное химическое использование этих слов отражает древнюю концепцию, согласно которой левый и правый имели моральные коннотации [24].
В химии эфирных масел также характерно, что различия в хиральном центре приводят к совершенно другой молекуле, а не только к другому энантиомеру. Такие соединения асимметричны, но не хиральны (без зеркального отражения), поэтому они являются диастереомерами, как упоминалось ранее. Диастереомеры могут быть результатом изменения одного из двух или более хиральных центров или, альтернативно, стереохимии групп заместителей относительно двойной связи. Например, соединение с двумя хиральными центрами может привести к эпимерам, в которых два соединения различаются только одним хиральным центром (глобулол (52) и ледол (53) являются эпимерами). Это может существенно изменить химические и фармакологические свойства соединения (рис. 3С). Такие изменения будут более выраженными между диастереомерами, чем между энантиомерами. Однако, если группы в обоих хиральных центрах изменены, полученное соединение является его энантиомером [24].
Соединение с двойной связью может находиться как в цис-, так и в транс-изомере, что делает его одним из двух диастереомеров. Это соглашение также можно использовать для одинарных связей, но только в алициклической молекуле (неароматическая кольцевая структура), где вращение вокруг одинарной связи не может происходить. Эти изомеры определяются группами заместителей, которые представляют собой неводородное присоединение к хиральному центру или стереоцентру (стереоцентр является более общим выражением, которое включает стереохимию на двойной связи, а также на хиральных центрах). Если группа заместителей в одном стереоцентре находится на той же стороне молекулы, что и группа в другом стереоцентре, она называется цис-, а на противоположных сторонах - транс- (рис. 3С). В частности, если стереоцентры находятся на противоположных сторонах двойной связи, обозначения Z- и E- могут использоваться для замены цис- и транс-, соответственно (Z- от немецкого слова zusammen, означающего вместе; E- от немецкого слово entgegen, означающее противоположное) [24].
Однако в обозначениях E и Z используются упомянутые ранее правила приоритета CIP. Цис- и транс-изомерия не имеет, но альтернативно отдает предпочтение неводородным группам, которые находятся в другом положении по сравнению с его известным диастереомером. Кроме того, цис- и транс-заместители не всегда очевидны, что делает это соглашение довольно произвольным. Такая неоднозначность чаще встречается в сложных молекулах или где в стереоцентре присутствует более двух различных типов элементов. Вот почему цис- и транс-изомерия рассматривается как относительная стереохимия (по отношению к его известному диастереомеру), тогда как Z- и E-обозначения считаются абсолютными. Таким образом, аналогично дескрипторам R и S, обозначения E и Z в алкенах (молекулах с двойными связями) не всегда транслируются в цис- и транс-изомерию одного и того же алкена. Однако это несоответствие должно происходить только в том случае, если в стереоцентре присутствует более двух различных типов элементов, например, в случае 2-хлорбут-2-ена, изображенного на рисунке 3C. Поэтому такой двусмысленности можно избежать, используя только E- и Z-нотацию для алкенов, где соглашение об использовании цис- и транс- еще не установлено [24].
Как упоминалось ранее, обычно диастереомеры могут быть обнаружены с помощью базовой газовой хроматографии или ЯМР до уровня их относительной (цис- или транс-) или абсолютной (Z- или E-) стереохимии, если об этом ранее сообщалось, но абсолютная стереохимия известные хиральные молекулы (S- или R-конфигурация хиральных центров) не могут быть реализованы без дальнейшего более полного исследования. Следовательно, при использовании такого неспециализированного оборудования невозможно различить энантиомеры в эфирном масле [24].
Важность хиральности возникает в химии эфирных масел, когда образцы искажаются ориентированными на прибыль производителями, которые фальсифицируют натуральные продукты более дешевыми синтетическими. Следовательно, необходимо регулярно принимать меры для подтверждения или опровержения заявлений о подлинности, сделанных продавцами и производителями на рынке. Производители эфирных масел также часто практикуют оптимизацию прибыли за счет фальсификации натуральных эфирных масел более распространенными натуральными, но более дешевыми эфирными маслами. Среди прочего, следствием любого вида фальсификации является то, что состав энантиомеров не отражает состав естественного эфирного масла. Дешевые производители зависят от того факта, что не будут использоваться какие-либо специальные методы для исследования состава их эфирных масел, но времена меняются [21,26].
Эфирные масла, биосинтезируемые растениями, состоят из множества компонентов, которые могут включать хиральные соединения. Обычно, если эти хиральные соединения синтезируются в лаборатории, будет получена смесь энантиомеров 50:50, но только если хиральный центр является частью реакции или если предшественник является рацемическим, что означает равное соотношение (50:50) энантиомеров. Такую смесь очень трудно разделить с помощью обычной недорогой хроматографии, в отличие от разделения диастереомеров, которые также образуются в реакциях синтеза и которые легче разделяются с помощью основной хроматографии. Поскольку разделять энантиомеры дорого и сложно, наличие рацемических смесей в натуральных продуктах является надежным показателем сокращения затрат и фальсификации [21].
Удельное вращение рацемата равно нулю, потому что вращение каждого из энантиомеров в сумме равно нулю. Хотя такая смесь называется рацематом, ее не следует путать со смесью с неравными пропорциями энантиомеров, которые могут встречаться в натуральных продуктах, часто в соотношении 40:60 [27]. Такая смесь называется энантиообогащенной или может быть определена как имеющая энантиомерный избыток (ee), который представляет собой цифру, которая показывает количество неспаренного энантиомера как массовый процент от целого (г / г), или насколько один энантиомер перевешивает другой. Таким образом, образцы энантиочистки (только один энантиомер) имеют ее 100%, тогда как рацемат имеет ее 0%. Кроме того, смесь с 75% R- или S-энантиомера будет иметь ее 50% (75 - (100-75) = 50). Другой способ взглянуть на это - представить, что энантиомерный избыток описывает часть смеси, которая не является рацемической (а не смесью энантиомеров один к одному) [21,24].
Поскольку высокая стереоспецифичность достигается в реакциях, катализируемых ферментами (биологических реакциях), такие природные хиральные соединения обычно энантиочистки, но не всегда. Несмотря на это, исследования, направленные на выяснение энантиомерного избытка эфирных масел, предоставляют рекомендации в отношении ожидаемых энантиотипов от выбранных исследуемых видов. Эта растущая область энантиотаксономии уже идентифицировала один или несколько энантиотипов в пределах одного вида, которые могут служить отпечатками пальцев там, где аутентификация является проблемой [21].
Следствием фальсифицированных эфирных масел является то, что они не обладают такими же фармакологическими или эстетическими качествами, как натуральные эфирные масла. Это было сделано неявно в более ранних исследованиях, где двойные слепые ольфактометрические исследования продемонстрировали, что энантиомеры дифференцировались по характеру запаха, который воспринимался специальной группой по запаху. В одном из таких исследований два энантиомера карвона (1) были синтезированы из энантиомерных образцов лимонена (3), в которых хиральные центры не были изменены в реакции, поэтому была достигнута высокая энантиомерная чистота карвонов. Используя группу из 21 надежного специалиста по запахам, запах (+) - карвона был охарактеризован как запах тмина, а (-) - карвон - как запах мяты [28]. Это согласуется с преобладающими энантиомерами тмина (Carum carvi L .: Apiaceae) и мяты колосистой (Mentha spicata L .: Lamiaceae) соответственно [21].
1.3. Химический анализ и стандартизация / Законодательство об эфирных маслах
Наиболее распространенный метод, используемый для определения химических характеристик эфирных масел, - это газовая хроматография в сочетании с масс-спектрометрией (ГХ-МС). Относительно небольшой размер компонентов эфирного масла означает, что все они летучие и поэтому могут быть разделены по температурам кипения. Этот процесс происходит в длинной тонкой колонне (30 м), имеющей вид спиральной проволоки. Эта колонка предварительно заполнена пористой неподвижной фазой, которая является полярной (слегка заряженной), такой как парафиновая колонка (полиэтиленгликоль; или DB-воск, Carbowax 20M, PEG-20M), или неполярной, такой как полиметилсилоксан (HP -1MS или 5% дифенил-т.е. HP-5MS). Чаще всего используется аполярная колонка HP-5MS [29].
Эфирное масло разбавляется растворителем и вводится в нагретую камеру для инъекций (например, до 300°C), поэтому все компоненты эфирного масла испаряются и доставляются доброкачественным (нереактивным) газом (например, азотом или гелием) в начало колонки, которое обычно находится при более низкой температуре (например, 60°C), поэтому компоненты эфирного масла осаждаются на колонке [29].
В газовой хроматографии разделение выполняется путем нагревания колонки в сушильном шкафу, чаще всего с использованием запрограммированного линейного изменения температуры от более низкой до более высокой температуры; однако иногда используются изотермические программы (с постоянной температурой). Когда используется температурная программа, разделение компонентов происходит, когда температура повышается до каждой из точек кипения отдельных компонентов. В этот момент компонент испаряется и переносится инертным газом к детектору [29]. Наиболее распространенным детектором, используемым в газовой хроматографии, является масс-спектрометр, но пламенно-ионизационный детектор (FID) часто используется там, где важна точность количественного определения.
При использовании FID невозможно узнать идентичность соединения. Однако, если идентичность соединения и время его удерживания (сколько времени требуется, чтобы выйти из колонки) уже известны из предыдущего эксперимента, то GC-FID можно использовать для расчета точного относительного содержания каждого компонента в эфирном масле. Обычно перед GC-FID для идентификации компонентов эфирного масла используется GC-MS. Хотя GC-FID дает более точные данные количественного определения, чаще используется менее точный метод количественного определения, который рассчитывается на основе хроматограммы GC-MS (рис. 4).
На хроматограмме GC-MS время удерживания компонентов обычно отражает их размер и присутствие функциональных групп (рис. 4). На рис. 4 элюирование компонентов начинается с монотерпенов (C10), затем идут оксигенированные монотерпены и завершаются сесквитерпенами (C15). Хотя на рисунке 4 показан масс-спектр нескольких выбранных компонентов, такая информация всегда отображается в отдельном окне.
В масс-спектрометрии отделенный компонент (например, лимонен, 3) фрагментируется ионизацией электронным ударом, в результате чего образуется спектр ионов, разделенных по массе, причем более тяжелые компоненты оказывают большее инерционное сопротивление магнитному полю, чем более легкие компоненты. В процессе магнитного отклонения своего пути ионы отклоняются на детектор. Результатом является спектр, показывающий ионы разных размеров с разным относительным содержанием. Этот спектр обычно можно рассматривать как отпечаток каждого компонента эфирного масла. Из-за воспроизводимости этого эксперимента каждый масс-спектр можно сравнивать в спектральной библиотеке. Используя другую информацию, такую как время удерживания, можно получить достаточно надежное соответствие, за небольшими исключениями [29].
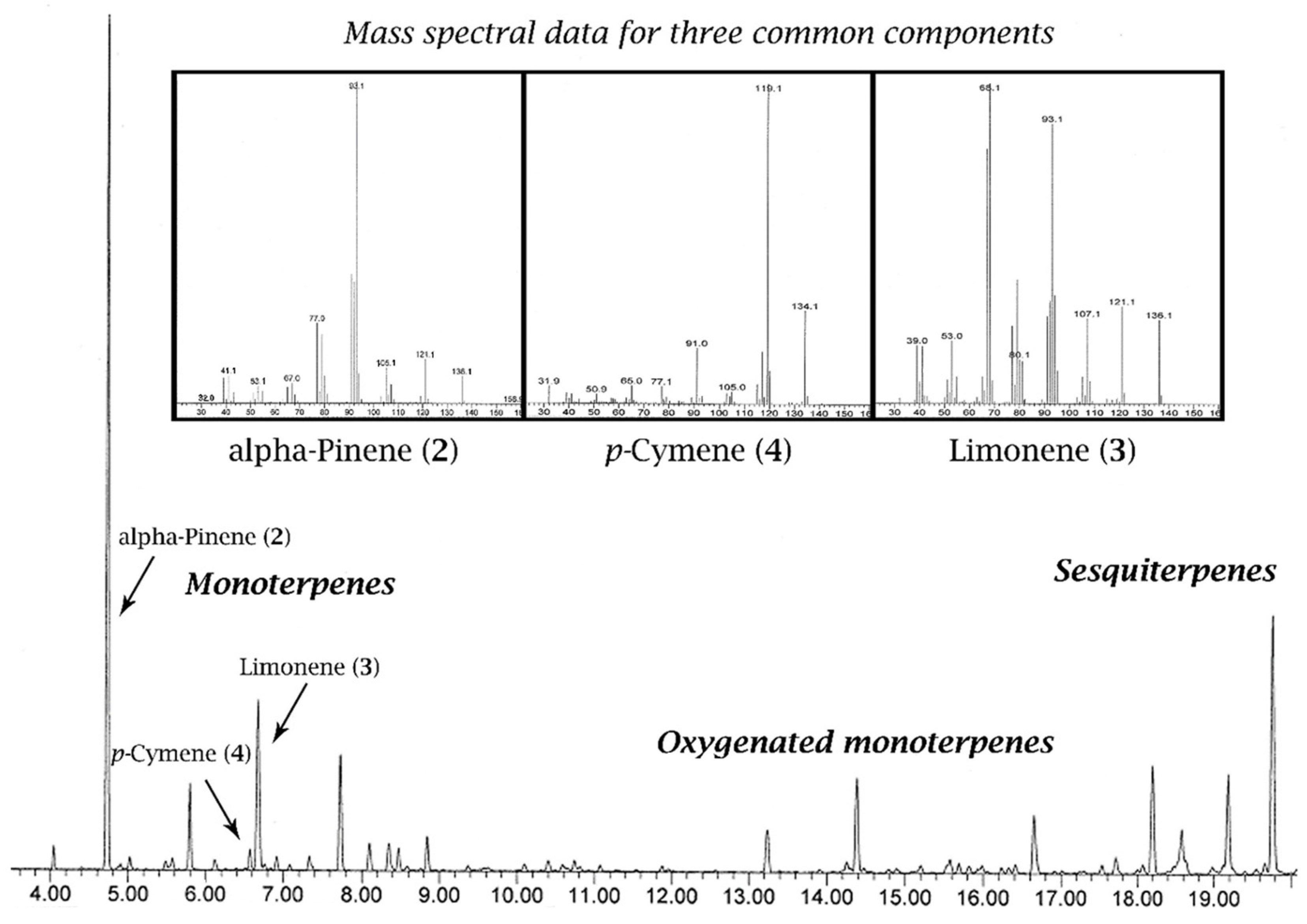
Рисунок 4. Газовая хроматограмма с масс-спектральными данными, наложенными для трех распространенных компонентов эфирного масла. На хроматограмме по оси абсцисс отложено время удерживания (RT) в минутах, а по оси ординат - количество в условных единицах.
Другой метод, заслуживающий упоминания, - это твердофазная микроэкстракция (ТФМЭ) или, проще говоря, анализ свободного пространства или абсорбция [30]. Этот метод доставляет летучие вещества на ГХ-МС, но позволяет избежать процесса экстракции или дистилляции растворителем. В этом методе используется адсорбционная твердая фаза, которая находится в свободном пространстве ароматического препарата. После этого либо твердая фаза может быть введена непосредственно в ГХ-МС, либо летучие вещества могут быть десорбированы в растворитель перед введением. Ряд адсорбентов используется в SPME, и они перечислены Reineccius [30].
После проведения анализа с помощью ГХ-МС, в котором присутствуют расхождения в идентификации, компоненты эфирного масла могут быть очищены с помощью флэш-хроматографии перед анализом с использованием спектроскопа ядерного магнитного резонанса (ЯМР). Флэш-хроматография достигается за счет упаковки силикагеля (полярная фаза) в вертикальную колонку со смесью растворителей. Эфирное масло добавляется в верхнюю часть колонки. Поскольку каждый компонент имеет разное сродство связывания с силикагелем, компоненты впоследствии можно вымыть по отдельности одним и тем же растворителем под давлением. Смесь растворителей подбирается в зависимости от полярности целевого соединения для оптимизации разделения [29].
ЯМР очищенного компонента обеспечит уникальный спектр сдвигов 13C или 1H, который можно сопоставить с опубликованным значением, если это известное соединение. Если нет, более полное структурное выяснение может быть выполнено с помощью экспериментов 2D-ЯМР. Кроме того, с помощью экспериментов 2D-ЯМР можно обнаружить новые структуры. Теория, лежащая в основе ЯМР, подробно объясняется в любом современном учебнике органической химии [24].
Спектральные данные, полученные с помощью ЯМР, а также масс-спектральные данные с ГХ-МС не помогут в различении энантиомеров. Кроме того, энантиомеры нельзя разделить ни полярной, ни неполярной неподвижной фазой в хроматографии, если не используется другое сродство связывания. Для этого в стационарную фазу включают энантиочистую добавку, наиболее распространенной из которых являются энантиочистые арильные или алкильные производные циклодекстрина (α-, β- или γ-циклодекстрины). Такая неподвижная фаза называется «хиральной колонкой», которую можно приспособить к ГХ-МС для хроматографического разделения энантиомеров. Эта методология, называемая энантиоселективной хиральной газовой хроматографией (энантио-cGC) [31], является предпочтительным выбором для аутентификации эфирных масел, поскольку не требует предварительного разделения. Можно ввести все эфирное масло, и хиральное соединение разделится на два пика. Без доступа к хиральной колонке можно использовать более примитивный метод, включающий флэш-хроматографию и поляриметр, но это оказывается очень затратным по времени и ресурсам.
Знание химического состава эфирного масла, а также энантиомерного избытка хиральных компонентов составляет наиболее важную часть процесса стандартизации. Если оба этих химических аспекта соответствуют опубликованному стандарту, другие физические параметры эфирного масла должны соответствовать. Таким образом, при правильном количестве компонентов в относительных количествах в пределах определенного диапазона и правильном энантиомерном составе оптическое вращение и показатель преломления всего эфирного масла, его цвет, плотность и внешний вид должны соответствовать определенному стандарту [3].
Однако эти другие параметры могут быть повышены, чтобы стать более значимыми инструментами аутентификации, когда эфирные масла фальсифицированы с маслами-носителями или разбавлены спиртом. Кроме того, это также может иметь значение, если эфирное масло производится с использованием метода, отличного от гидро- или паровой дистилляции. Это уместно при производстве абсолю или масел, полученных методом холодного отжима, таких как ранее упомянутый пример бергамота (Citrus bergamia Risso and Poit). В этом случае будут присутствовать компоненты, отличные от тех, которые определены в ГХ-МС; компоненты, которые не являются летучими или газообразными. Таким образом, для целей стандартизации необходимы все параметры аутентификации, а не только химический характер, определенный с помощью газовой хроматографии.
Еще один фактор, который следует учитывать при подготовке или изучении опубликованных стандартов эфирных масел, - это наличие хемотипов. Чрезвычайно часто для одного вида, дающего эфирное масло, образуются разновидности эфирных масел, называемые хемотипами. Хемотипы часто возникают там, где географические или геологические различия влияют на диверсификацию биосинтетических путей. Хемотипы могут быть результатом расходящихся эволюционных путей или факторов окружающей среды, таких как тип почвы или высота над уровнем моря. В тех случаях, когда хемотипы встречаются у вида, опубликованные стандарты, как правило, специфичны, например, стандарт масла чайного дерева (Melaleuca alternifolia Cheel), установленный Международной организацией по стандартизации (ISO: Женева, Швейцария), уточняет описываемый хемотип: “Oil of Melaleuca, terpinene-4-ol type (Tea Tree Oil)’ (ISO 4730:2004) [3]. Стандарт, описанный ISO, идентичен стандарту, описанному в Standards Australia (AS 2782-2009) [32] (рисунок 5).
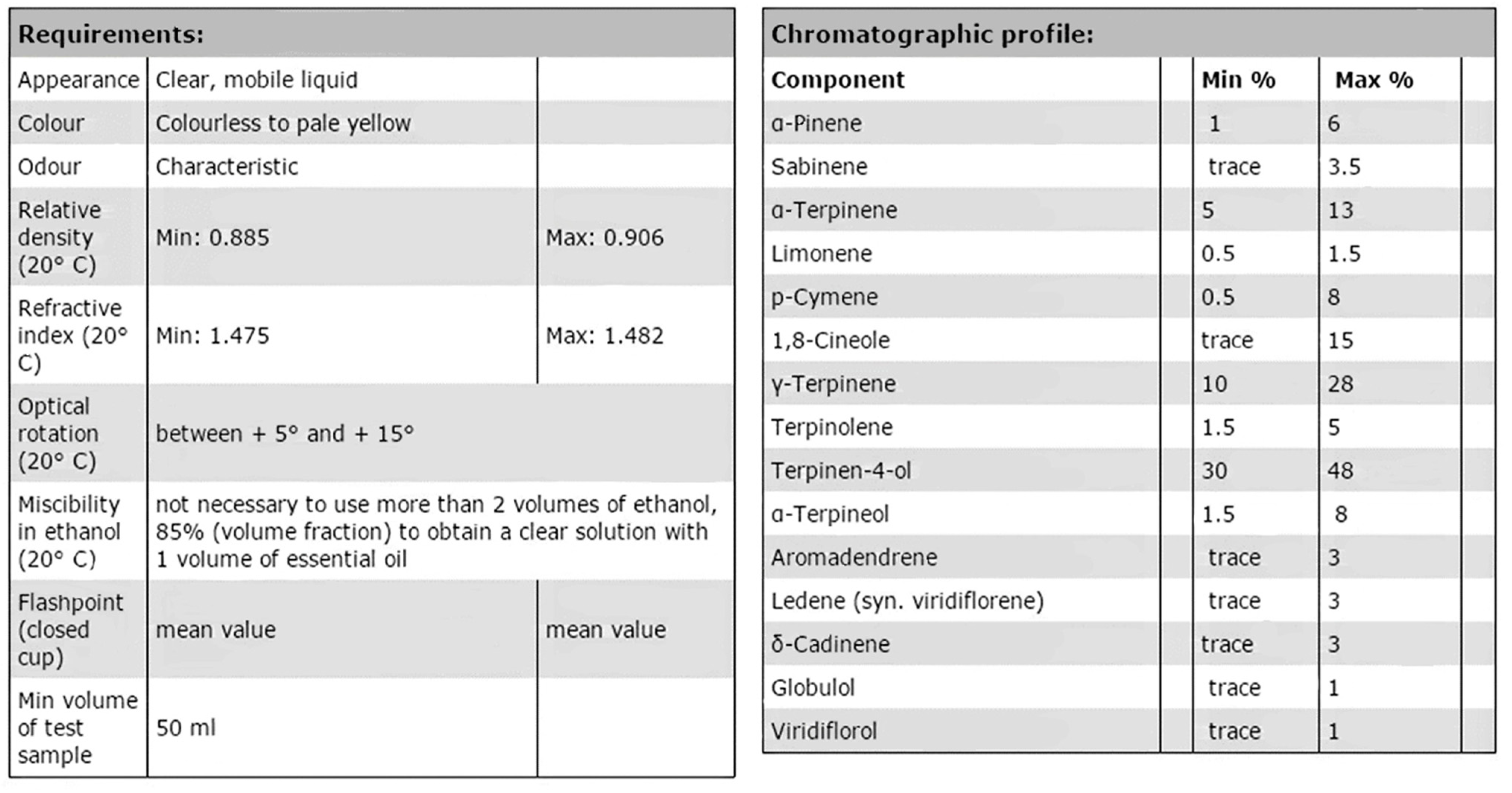
Рисунок 5. Австралийский стандарт содержания химических компонентов в масле чайного дерева (AS 2782: 2009), хемотип терпинен-4-ол, стандарты Австралии [32].
Стандарт ISO определяет масло чайного дерева как:
«Эфирное масло, полученное паровой дистилляцией листьев и молодых веточек Melaleuca alternifolia (Maiden et Betche) Cheel, Melaleuca linariifolia Smith и Melaleuca disitiflora F. Mueller, а также других видов Melaleuca, при условии, что полученное масло соответствует требованиям, приведенным в настоящем международном стандарте».

Что касается появления хемотипов, также требующих опубликованных стандартов, а также информации, относящейся к энантиотаксономии, органам по стандартизации во всем мире предстоит многое наверстать. Однако те органы по стандартизации, которые считаются наиболее надежными с точки зрения описания химических компонентов эфирных масел, - это упомянутый ранее ISO и “Association Française de Normalisation” (AFNOR: France) [33]. Другие органы по стандартизации включают Британскую [34], Международную, Европейскую фармакопеи и Фармакопеи США. Хотя в Австралии нет фармакопеи как таковой, австралийские стандарты соблюдаются Стандартами Австралии [32].
Вкратце, все стандарты хранятся под ссылочным номером, который включает номер файла и год последнего пересмотра. Опубликованные стандарты также должны соответствовать стандартам измерения и представления, которые также определены ISO, однако эквивалентные ссылки в Австралии перечислены вместе со ссылками на ISO в таблице 1. Для просмотра любого из этих стандартов они должны быть сначала приобретены у организации. Хотя стандарты не применяются законом, производители эфирных масел могут гарантировать воспроизводимость и надежность, если их продукция соответствует общепринятому стандарту.
Таблица 1. Эквивалентные ссылки между Международной организацией по стандартизации (ISO) и Австралийскими стандартами (AS) в отношении эфирных масел и подготовки стандартов к публикации.
| Reference to International Standard (ISO) |
Australian Standard (AS) |
| 212 |
Essential oils—Sampling |
4550 |
Essential oils—Sampling |
| 11024 |
Essential oils—General guidance on chromatographic profiles |
5025 |
Essential oils—General guidance on chromatographic profiles |
| 11024-1 |
Part 1: Preparation of chromatographic profiles for presentation in standards |
5025.1 |
Part 1: Preparation of chromatographic profiles for presentation in standards |
| 11024-2 |
Part 2: Utilization of chromatographic profiles of samples of essential oils |
5025.2 |
Part 2: Utilization of chromatographic profiles of samples of essential oils |
Недавние проблемы в аутентификации масла чайного дерева были решены, когда было обнаружено, что энантиомерный избыток большинства хиральных компонентов масла чайного дерева был подобен маслу эвкалипта. Таким образом, производители масла чайного дерева могли обманным путем добавлять компоненты из масла эвкалипта для приведения уровней в соответствие со стандартом ISO, а способность enantio-cGC обнаружить это была ограничена. В этом случае enantio-cGC может быть дополнен масс-спектрометрией изотопных соотношений. Из-за различных кинетических и термодинамических факторов у разных видов во время первичной фиксации углекислого газа в процессе фотосинтеза изотопные отношения углерода варьируются между видами Melaleuca и Eucalyptus [31]. Следовательно, если изотопные отношения углерода не соответствуют известным отношениям для Melaleuca, эфирное масло можно рассматривать как фальсифицированное.
Не только стандартизация регулирует производство эфирных масел. Стандартизация просто обеспечивает воспроизводимость и соответствие, но там, где такие стандарты используются при формулировании продуктов, законодательство обеспечивает основу. Основная цель законодательства - регулировать количество биологически активного материала, добавляемого в продукт, в какой концентрации и объем информации, предоставляемой потребителю (в качестве ингредиентов), с тем, чтобы обеспечить контроль за здоровьем и безопасностью. Хотя многие могут относиться к законодательству с неприязнью, с противоречивыми взглядами и нерешительностью по всем направлениям, такое законодательство действительно влияет на использование эфирных масел, и поэтому ему следует уделять должное внимание.
Как правило, безопасность эфирного масла трудно предсказать, просто изучив его химический состав. Это связано с тем, что встречающиеся в природе комбинации редко демонстрируют такую же биологическую активность, как отдельные компоненты. Однако первый индикатор биологической активности эфирного масла использует подход, основанный на компонентах [35]. При использовании подхода на основе компонентов наиболее часто упоминаемые примеры потенциально опасных соединений связаны с гепатотоксичностью, фототоксичностью и сенсибилизацией кожи. Безусловно, подавляющее большинство из них содержат ароматические фрагменты, такие как фенильная, фенольная или метоксифенольная группа. Фототоксичность довольно часто встречается у эфирных масел, полученных из видов цитрусовых, что приписывается сенсибилизирующим к ультрафиолету компонентам, принадлежащим к группам кумарина или фуранокумарина (например, бергаптену (31)) [36]. В контексте гепатотоксичности соединения, производные фенилпропаноидов, такие как метоксифенолы сафрол (14) и метилэвгенол (15), считаются опасными и канцерогенными [37]. Действительно, в австралийском контексте появление редкого хемотипа Eremophila longifolia F. Muell, который дает эфирное масло, полностью состоящее из этих двух компонентов, поставило под сомнение безопасное использование этого вида в течение долгого времени, прежде чем были описаны другие безопасные хемотипы [38].
Фенолы, такие как карвакрол (13) и тимол, считаются опасными, если потребляются в больших количествах или в более низких дозах, но в течение длительного периода времени, что приводит к гепатотоксичности. Масла с высоким содержанием кетонов, такие как вызывающий аборты пулегон (40), или альдегиды также следует использовать с осторожностью, но, конечно, есть много исключений из правил, таких как эфирное масло из Mentha piperita L, которое содержит большое количество ментона ( 39) [37].
Основная идея текстов, описывающих безопасность эфирных масел, заключается в том, что, хотя большинство из них можно считать безопасными при осознанном использовании, то, что они просто «натуральные», не означает, что их можно использовать без учета дозировки, «… ни одно вещество не является безопасным вне зависимости от дозы»[35]. Первый исчерпывающий текст по изучению безопасности эфирных масел был составлен в 1995 году Тиссерандом и Балаком [36], и в нем описывается несколько случаев госпитализации взрослых или детей, которые употребляли «безопасные» эфирные масла в небезопасных дозировках. Эта книга также включает множество анекдотических ситуаций, таких как случай с 11-летним ребенком, несущим в кармане флакон эфирного масла Cinnamomum zeylanicum Blume. Когда бутылка разбилась, мальчик носил те же штаны еще 48 часов и получил сильный ожог в области кармана. В другом случае нанесение камфары (17) на ноздри ребенка привело к мгновенному коллапсу, тем самым продемонстрировав влияние места нанесения [36].
При использовании эфирных масел большое значение имеет сенсибилизация, когда в определенных местах возникают аллергические реакции. Список этих аллергенов был составлен в недавнем исследовании, в котором частота сенсибилизации переходит в классификацию по группам. В порядке убывания приоритета аллергены группы 1 являются более серьезными, чем группы 2 или 3. Согласно первой поправке к «Правилам использования моющих средств и маркировке аллергенов», если какой-либо из этих аллергенов присутствует в моющем средстве или косметическом продукте, это обязательно следует декларировать независимо от способа добавления (например, в составе эфирного масла). В соответствии с директивой по ароматизаторам для биологически активных веществ установлены различные максимальные и минимальные уровни [35].
В то время как Европейский Союз контролирует законодательство о терапевтических товарах в Европе, в австралийском контексте такое одобрение регулируется Управлением терапевтических товаров (TGA) [39]. Когда в 1989 г. был принят Закон о лечебных товарах, ряд натуральных продуктов для дома был внесен в «Австралийский реестр терапевтических товаров» (ARTG), например, эвкалипт или масло чайного дерева. Однако австралийские натуральные продукты, которые не стали нарицательными, такие как другие лекарства аборигенов, не могли быть включены в ARTG без 75 лет документально подтвержденного использования с четкими руководящими принципами в отношении точного метода приготовления и безопасного использования. Поскольку "Materia medica" австралийских аборигенов в основном передавалась устно или задокументирована в книгах с минимальными подробностями, процесс получения разрешения ARTG на такие натуральные продукты является непростой задачей. Таким образом, исчерпывающее документирование такого использования должно начинаться с альтруистического подхода на благо будущих поколений.
Продолжение, часть 2
Оригинал статьи:
A Contemporary Introduction to Essential Oils: Chemistry, Bioactivity and Prospects for Australian Agriculture
https://www.mdpi.com/2077-0472/5/1/48/htm
Sadgrove, Nicholas, and Graham Jones. 2015. “A Contemporary Introduction to Essential Oils: Chemistry, Bioactivity and Prospects for Australian Agriculture.” Agriculture 5 (1):48–102. https://doi.org/10.3390/agriculture5010048.